Sex determination , or determination of sex , is a biological process during which the sexual characteristics of an organism develop. Most species of organisms have two sexes. Sometimes hermaphrodites are also found, combining the signs of both sexes. Some species have only one sex and represent females that reproduce without fertilization by parthenogenesis , during which exclusively females are born.
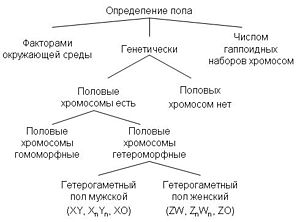
Sexual reproduction and manifestation of sexual dimorphism is widespread in various taxonomic groups. The mechanisms of sex determination are characterized by a wide variety, which indicates the frequency and independence of the occurrence of sex in various taxa [2] .
In many cases, gender is genetically determined. Genetic determination of sex is the most common way of determining sex in animals and plants , sex can be determined by a series of alleles of one or more autosomal genes, or sex determination can be performed using sex chromosomes with sex-determining genes (see Chromosomal sex determination ) [2 ] . In chromosomal sex determination, the set of sex chromosomes in males and females is usually different due to their heteromorphism, and sex is determined by combinations of sex chromosomes: XY , ZW , X0 , Z0 . In other cases, gender is determined by environmental factors. For example, in all crocodiles , some lizards , turtles , fish and hatteria, the sex depends on the temperature at which the individual developed. Ants , bees , wasps and some other insects have another mechanism: sex depends on the number of chromosome sets . Haploid males develop from unfertilized eggs, and diploid females from fertilized [1] . Some species do not have a constant sex and can change it under the influence of external stimuli. The details of some sex determination mechanisms are not yet fully understood.
The determination of sex should be distinguished from sex differentiation. After the determination of sex by any of the above mechanisms, sexual differentiation is triggered. This launch, as a rule, is carried out by the main gene - the sexual locus , after which, by a cascade mechanism, the remaining genes are included in the process.
Classification of mechanisms of sex determination
The sex of the body can be determined at different stages relative to the moment of fertilization, depending on this there are 3 types of sex determination:
- progamous sex determination is carried out before fertilization in the process of oogenesis , and sex is determined by the properties of the egg , progamous sex determination is found in a small number of animals (see. Progamous sex determination );
- gender determination of sex occurs during fertilization, and gender is determined genetically.
- with epigamous (metagamic) sex determination, the sex of the embryo is established after fertilization and depends on environmental factors, which can be considered as modification variability [3] .
Pre-Sex Determination
As described above, progamous sex determination occurs before fertilization, in the process of egg formation. This is the case, for example, in rotifers . They form ovules of two varieties: large, with two sets of chromosomes ( diploid ) and a large volume of cytoplasm, and small, with one set of chromosomes - haploid . From haploid unfertilized eggs, haploid males develop, producing haploid gametes. If now the haploid male fertilizes the haploid egg, then the female will develop. Females also develop from large diploid eggs, but in this case they appear not as a result of fertilization, but parthenogenetically, that is, without fertilization. Thus, the sex of an individual developing from a diploid egg is determined even at the stage of egg formation (at this stage its diploidy is laid), and the sex of an individual developing from a small egg depends on whether it is fertilized or not [4] .
Chromosomal sex determination
In plants and animals, the most common chromosome mechanism for determining sex. Depending on which gender is heterogametic , the following types of chromosome sex determination are distinguished:
- females are homogametic, males are heterogametic
- females XX ; males xy
- females XX ; males X0
- females are heterogametic, males are homogametic
- females of ZW ; males zz
- females Z0 ; males zz
In individuals of a homogametic sex, the nuclei of all somatic cells contain a diploid set of autosomes and two identical sex chromosomes , which are designated as XX ( ZZ ). Organisms of this sex produce gametes of only one class - containing one X ( Z ) chromosome. In individuals of the heterogametic sex, in each somatic cell, in addition to the diploid set of autosomes, there are either two different-quality sex chromosomes, designated as X and Y ( Z and W ), or only one - X ( Z ) (then the number of chromosomes is odd). Correspondingly, two classes of gametes are formed in individuals of this sex: either bearing X / Z chromosomes and Y / W chromosomes, or carrying X / Z chromosomes and not bearing any sex chromosomes [5] .
In many species of animals and plants, the female sex is homogeneous , and the male is heterogeneous. These include mammals [6] , some insects [7] , some fish [8] and some plants [9] and others.
Homogamous males and heterogametes females have birds, butterflies, and some reptiles [10] .
The origin of sex chromosomes
Sex chromosomes can be very similar, differing only in a small area ( homomorphic ), however, in most cases, sex chromosomes are heteromorphic . In the latter case, one of the sex chromosomes is large and rich in genes (X or Z), and the other contains a small number of genes, extended heterochromatic sites and has a small size (Y or W) [11] . Heteromorphic sex chromosomes are not capable of synapsis and recombination in meiosis , with the exception of small areas called pseudo - autosomal .
According to modern concepts, sex chromosomes arose from a pair of homologous autosomal chromosomes. The key event in the transformation of these chromosomes into sex chromosomes was the appearance in them of a region in which crossingover is suppressed, that is, a region in which recombination does not occur on protonosomes . Presumably, this site contained two genes, one of which determined sex, and the second had sexual antagonism, that is, the alleles of this gene had an opposite effect on the fitness of the sexes. A section with a “locked” crossing-over united the alleles of these two genes on the Y (W) chromosome in such a way that the allele defining the heterogametic sex turned out to be in stable combination with the allele of the second gene, which increased the fitness of this sex [12] [13] . The non-recombining region of the Y (W) chromosome, as a rule, then expanded and accumulated mutations over time, mainly due to a mechanism called Möller ratchet . In addition to the Möller ratchet, other processes, such as , and also contributed to the accumulation of mutations on the Y (W) chromosome [14] . The accumulation of harmful mutations led to the degeneration of Y (W) chromosomes: they became more heterochromatic, genetically inert, the number of functional genes in them rapidly decreased. Moreover, the second chromosome from the initial autosomal pair, which has the ability to recombine with the same chromosome in individuals of the homogametic sex, retained the original gene composition.
A comparative study of sex chromosomes in a group of mammals made it possible to point to yet another mechanism that influenced the morphology of sex chromosomes. In 1995, Professor Jenny Marshall Graves from the Australian National University hypothesized that protonosomes were small and increased due to several cycles of adding fragments of different autosomes, followed by degradation of these fragments on the Y chromosome. According to this hypothesis, pseudo-autosomal regions that retain the ability to synapse in prophase I of meiosis are the last fragments added to the gonosomes [15] .
The generally accepted opinion regarding the evolution of sex chromosomes XY and ZW in the group of amniotes in mammals , birds, and snakes is that they arose independently from different autosomal pairs of ancestral reptiles whose sex was determined by temperature [16] [17] . At the same time, the mammals developed the XY system for determining sex, while in snakes and birds, independently, the ZW system [17] .
In mammals, one chromosome from the original autosomal pair — now the Y chromosome — underwent a mutation in the SOX3 gene, as a result of which it turned into the SRY gene , and the former autosome began to determine sex [17] [18] [19] . After this mutation, the site of the proto-Y chromosome containing SRY was captured by intrachromosomal rearrangement , namely chromosomal inversion . This led to the prohibition of recombination in this area. Due to the lack of a partner for recombination, the Y chromosome began to accumulate mutations, and over time it degenerated [17] . Sites of X- and Y-chromosomes that have remained homologous to each other, known as pseudo-autosomal regions , are the result of a later transfer of genetic material from one of the autosomes to gonosomes [15] [20] .
There are species in which sex chromosomes are at an early stage of differentiation. For example, in Japanese fish, the medaka ( Oryzias latipes ) sex chromosomes are homomorphic with the exception of a small locus 258 thousand bp in length, in which there is a ban on recombination [21] . In the medaka, the Y chromosome continues to exchange genes with the X chromosome in the remaining regions [22] .
Thus, a comparative analysis of sex chromosomes in various taxa allows us to highlight their main features: heteromorphism, which is manifested morphologically and at the genetic level; heterochromatization of Y (W) chromosomes, leading to genetic inertness; the presence of pseudo-autosomal regions and the region of the prohibition of recombination with half-determining alleles; dose compensation for X (Z) chromosomes. The sequence of evolutionary events on the isolation of Y (W) chromosomes includes the following stages: a pair of autosomes → the appearance of half-determining alleles → the appearance of a region of inhibition of recombination → the expansion of the boundaries of the region of inhibition of recombination → degeneration of the Y (W) chromosome [23] .
XY sex determination
XY sex determination is the most common; such a sex determination system works in humans , as well as in the vast majority of mammals. In this system, females have two identical sex chromosomes XX, and males have two different sex chromosomes X and Y. A pair of sex chromosomes XY are not similar in shape, size and gene composition, which distinguishes them from pairs of autosomal homologs. Sex chromosomes X and Y are also called "gonosomes." Some species, including humans, have the SRY gene on their Y chromosome, which identifies the male principle. In others, for example, a fruit fly ( Drosophila melanogaster ), gender depends on the ratio of the number of X chromosomes (X) and sets of autosomes (A). If it is 1, a female develops from it, if 0.5 is a male. With an intermediate ratio of (0.67), intersexes develop - something between males and females. With a ratio> 1, metas-females (super-females) develop, with a ratio of <0.5 - metas-males (supermales). Both super-males and super-females are weak and die early. Moreover, the Y chromosome does not play a role in determining sex, but it is necessary for sperm formation [24] .
In species whose Y chromosome has the sex-determining SRY gene, viable individuals with the XXY karyotype can be found [25] . In this case, a person develops Klinefelter syndrome . In humans, gender is determined by the presence of the SRY gene. When it is activated, gonad rudiment cells begin to produce testosterone and anti-muller hormone , triggering the development of male genital organs [25] . In women, these cells secrete estrogen , which directs the development of the body along the female pathway. Not all organisms remain without sexual characteristics for some time after conception ; for example, in fruit flies, sex is determined almost immediately after fertilization [25] . When determining sex by the presence of the Y chromosome, the SRY gene is not the only one that affects gender development. Although SRY is the main gene that determines the male principle, multiple genes are required for testicular development. In mice with the XY system, the absence of the DAX1 gene on the X chromosome leads to sterility , but in humans, X-linked congenital adrenal hypoplasia develops in this case [26] . If the X chromosome carries an excess of DAX1 genes, then the female gender develops, despite the presence of the SRY gene [27] . Also, if the female body has two normal sex X chromosomes, duplication or expression of the SOX9 gene leads to testicular development [28] [29] . In mature male mice, a gradual sex change to female is possible if they transplant the FOXL2 gene from a female [30] . Although the DMRT1 gene is found in the bird's sexual loci, species with the XY system also depend on DMRT1, which is located on the 9th chromosome , for sexual differentiation at some points of development [25] .
The XY sex determination system is found in the vast majority of mammals, as well as in some insects. Some fish also use variants of this system. For example, in multicolor pecilia ( Xiphophorus variatus ), in addition to a pair of sex chromosomes XY, there is a second Y chromosome, denoted as Y '. Due to this, females XY 'and males YY' appear [22] . Some rodents , for example, some voles ( Arvicolinae ) ( voles and lemmings ) are also notable for their unusual sex determination mechanisms.
In 2004, scientists from the Australian National University in Canberra discovered that the platypus ( Ornithorhynchus anatinus ) has 10 sex chromosomes. Accordingly, the combination XXXXXXXXXX gives the female , and XYXYXYXYXY gives the male . On all X- and Y-chromosomes of the platypus there are homologous pseudo-autosomal regions, due to which X- and Y-chromosomes conjugate to each other during male meiosis prophase I. This leads to the fact that all sex chromosomes during the prophase I of male meiosis are connected into a single complex, with subsequent meiotic division they are capable of ordered segregation. As a result, males form spermatozoa with sex chromosome sets XXXXX or YYYYY. When sperm XXXXX fertilizes an egg, female platypuses are born, if sperm YYYYY is male platypuses. Although the platypus has an XY system, its sex chromosomes do not show homologs among the sex chromosomes of the placental ( Eutheria ) [31] . At the same time, the homolog of the sex chromosomes of the placental is localized on the 6th chromosome of the platypus. This means that the sex chromosomes of the placental were autosomes at the time when the single pass were separated from the animals ( Theria ) ( marsupials and placental). However, genes characteristic of the bird's Z chromosome, including the Dmrt1 gene, which, presumably, plays the main role in determining sexes in birds, were found on the X chromosomes of the platypus [32] . В целом геномные исследования показали, что пять половых X-хромосом утконоса имеют участки, гомологичные Z-хромосоме птиц [33] . Для определения конкретного гена, определяющего пол у утконоса, необходимы дополнительные исследования [34] . Для него характерна неполная дозовая компенсация , недавно описанная у птиц. Видимо, механизм определения пола утконоса сходен с таковым у его предков-рептилий.
X0-определение пола
Эта система представляет собой вариант XY-системы. Самки имеют две копии половой хромосомы (XX), а самцы — только одну (X0). 0 означает отсутствие второй половой хромосомы. В этом случае, как правило, пол определяется количеством генов, экспрессируемых на обеих половых хромосомах. Эта система встречается у некоторых насекомых, в том числе кузнечиков и сверчков из отряда прямокрылые ( Orthoptera ), а также тараканов ( Blattodea ). У небольшого числа млекопитающих также отсутствует Y-хромосома. К ним относятся мышевидные грызуны Tokudaia osimensis и Tokudaia tokunoshimensis , а также обыкновенная бурозубка ( Sorex araneus ) из землеройковых ( Soricidae ). Горная слепушонка ( Ellobius lutescens ) также имеет форму X0-определения пола, в которой у обоих полов отсутствует вторая половая хромосома [27] . В этом случае механизм определения пола ещё не до конца понятен [35] .
У нематоды C. elegans самец имеет одну половую хромосому (Х0); две же половые хромосомы (ХХ) соответствуют гермафродиту [36] . Главным половым геном у неё является XOL, который кодирует белок XOL-1 , а также контролирует экспрессию генов TRA-2 и HER-1 . Эти гены уменьшают или увеличивают активность мужских генов [37] .
ZW-определение пола
ZW-определение пола встречается у птиц, рептилий , некоторых насекомых ( бабочек ) и других организмов. ZW-система обратна XY-системе: самки имеют две различные половые хромосомы (ZW), а самцы — одинаковые (ZZ). У курицы ген DMRT1 является ключевым полообразующим геном [38] . У птиц гены FET1 и ASW , имеющиеся в W-хромосоме самок, сходны с геном SRY Y-хромосомы [25] . Однако не у всех организмов пол зависит от наличия W-хромосомы. Например, у молей и бабочек самки имеют кариотип ZW, но встречаются также самки Z0 и ZZW [36] . Кроме того, хотя у самок млекопитающих инактивируется одна из Х-хромосом, у самцов бабочек этого не наблюдается, и они образуют вдвое больше нормального количества ферментов , так как имеют две Z-хромосомы [36] . Поскольку ZW-определение пола широко варьирует, до сих пор неизвестно, как именно большинство видов определяют свой пол. Несмотря на сходства между XY и ZW, эти хромосомы возникли раздельно. В случае куриц их Z-хромосома наиболее похожа на человеческую 9-ю хромосому [39] . Куриная Z-хромосома также предположительно является родственной Х-хромосомам утконоса [40] . Когда ZW-виды, например, комодский варан ( Varanus komodoensis ), размножаются партеногенетически , рождаются только самцы. Это происходит из-за того, что гаплоидные яйца удваивают свои хромосомы, в результате чего получается ZZ или WW. Из ZZ развиваются самцы, в то время как WW нежизнеспособны и не развиваются далее яйца [41] .
Вероятно, исходным для бабочек механизмом определения пола был механизм Z0 самка/ZZ самец [42] . Затем, путём хромосомных перестроек, возникла система определения пола WZ самка/ZZ самец, характерная для 98 % видов бабочек. У тутового шелкопряда (система WZ/ZZ) обнаружен отвечающий за развитие женского пола ген Fem в W-хромосоме.
Z0-определение пола
При Z0-системе определения пола мужские особи имеют кариотип ZZ, а женские — Z0. Иными словами, у видов с системой Z0/ZZ определение пола зависит от соотношения числа пар половых хромосом и аутосом. Такое определение пола встречается у некоторых молей [43] [44] .
Гаплодиплоидность
Сущность гаплоидиплоидности заключается в том, что генотипы самцов и самок различаются на геномном , а не хромосомном , уровне: гаплоидный организм развивается в самца, а диплоидный — в самку [45] . Гаплодиплоидность встречается у насекомых отряда Перепончатокрылые ( Hymenoptera ), например, муравьёв и пчёл . Неоплодотворённые яйца развиваются в гаплоидных самцов [45] . Диплоидные особи, развивающиеся из оплодотворённых яиц, как правило, являются самками [45] , но могут быть и стерильными самцами. У самцов не может быть отцов и сыновей. Если пчелиная матка спаривается с одним трутнем, её дочери имеют ¾ общих генов, а не ½, как в XY- и ZW-системах. Предполагается, что это имеет важное значение для развития эусоциальности , поскольку это увеличивает роль кин-отбора , но такая точка зрения оспаривается [46] . Большинство самок перепончатокрылых могут выбирать пол своих потомков, сохраняя полученную сперму в сперматеке и выпуская или не выпуская её в яйцевод . Это позволяет им создавать больше рабочих особей в зависимости от состояния колонии [47] .
Эпигамное определение пола
Температурозависимое определение пола
Помимо генетических, существует много других механизмов определения пола. У некоторых рептилий пол определяется температурой, в которой развивалось яйцо в течение температурочувствительного периода. Это явление носит название температурозависимого определения пола ( англ. temperature-dependent sex determination (TSD) ).
К видам с температурозвисимым определением пола относятся все крокодилы , большинство черепах, некоторые виды ящериц [48] , а также гаттерии [49] . Обычно при низких температурах (ниже 27 ºС) из яиц вылупливаются особи одного пола, при высоких (выше 30 ºС) — другого, и только в небольшом промежуточном интервале — особи обоих полов. Так, у черепах при низких температурах появляются только самцы, у ящериц — только самки. Существуют отклонения от этой схемы. У каймановой черепахи при температурах от 20 до 30 ºС преобладают самцы, за пределами этого интервала — самки [48] . Эти температурные пороги обозначаются как порог I и порог II соответственно. Температуры, необходимые для развития каждого пола, называются женскими и мужскими благоприятствующими температурами ( англ. the female and the male promoting temperature ) [50] .
У миссисипского аллигатора только самки рождаются при температуре ниже 30 ºС, только самцы — при температуре выше 34 ºС. Температура в гнезде, однако, зависит от его месторасположения. В гнёздах, устроенных на береговом валу, температура обычно выше (34 и более ºС), во влажных маршах — ниже (30 и менее ºС) [48] [51] . Кроме того, температура может быть различной в верхней и нижней части гнезда.
Температурная детерминация пола происходит в определённый период эмбрионального развития. У каймановой черепахи это средняя треть инкубационного периода [48] , у миссисипского аллигатора — период между 7 и 21 сутками инкубации [51] .
Существует гипотеза, что температурная детерминация пола была характерна для динозавров, что явилось одним из фактором их вымирания при изменении климата в ареале [51] .
Среди птиц не обнаружено температурозависимого определения пола (это относится и к сорным курам ( Megapodiidae ), у которых, как раньше считалось, имеет место этот феномен, но смертность их зародышей в самом деле зависит от температуры) [49] .
Температурная зависимость пола обусловлена синтезом в организме различных ферментов. Виды, определение пола у которых зависит от температуры, не имеют гена SRY, но имеют другие гены, например, DAX1, DMRT1 и SOX9, которые экспрессируются или не экспрессируются в зависимости от температуры [50] . У некоторых видов, например, нильской тилапии ( Oreochromis niloticus ), некоторых сцинковых ( Scincidae ) и агамовых ( Agamidae ) пол определяется хромосомами, но впоследствии он может быть изменён при воздействии на яйца определённых температур [22] . Эти виды, вероятно, находятся на промежуточном этапе эволюции .
Неизвестно, как именно проходило развитие температуро-зависимого определения пола [52] . Возможно, оно появилось у тех полов, которые были приурочены к определённому ареалу , удовлетворявшему их температурным требованиям. Например, тёплые районы хорошо подходили для гнездования , так что в них рождалось больше самок, чтобы повысить число гнездований в следующем сезоне. Однако эта версия — пока всего лишь гипотеза [52] .
Температурная детерминация пола у некоторых видов черепах
Температурная детерминация пола у некоторых видов ящериц
Другие системы определения пола
В то время как температурное определение пола распространено относительно широко, существует много других систем определения пола, зависящих от факторов окружающей среды. Некоторые виды, например, некоторые улитки , практикуют смену пола: изначально взрослая особь имеет мужской пол, затем становится самкой [53] . У тропических рыб-клоунов ( Amphiprioninae ) доминирующая особь в группе становится самкой, в то время как другие особи являются самцами [54] . У талассомы синеголовой ( Thalassoma bifasciatum ) пол также может меняться [54] . У морского червя эхиуриды Bonellia viridis личинка становится самцом, если она попадёт на хоботок или тело самки, и самкой, если она попадёт на дно. Направление развития личинки, попавшей на самку, по мужскому пути вызывается химическим веществом, выделяемым кожей самки, — бонеллином [55] . Самцы и самки Bonellia viridis имеют одинаковый генотип, но при этом у них имеет место крайне выраженный половой диморфизм — самцы паразитуют в половых протоках самки, выполняя свою единственную функцию — оплодотворение яйцеклеток [56] .
У некоторых видов, однако, вовсе нет системы определения пола. Такие животные, как дождевой червь и некоторые улитки, являются гермафродитами [53] [54] . Небольшое число видов рыб, рептилий и насекомых размножаются партеногенезом и все являются самками. Существуют рептилии, например, обыкновенный удав ( Boa constrictor ) и комодский варан, которые могут размножаться половым путём, если есть возможность спаривания, и партеногенезом в противном случае [57] . В случае обыкновенного удава партеногенетическое потомство может быть представлено как самками, так и самцами. У некоторых членистоногих пол может определяться инфекцией , а именно бактерией Wolbachia , способной изменять пол заражённого животного [8] . Некоторые виды целиком состоят из особей ZZ, и пол определяет присутствие Wolbachia [58] .
Некоторые другие механизмы определения пола описаны ниже:
| Organism | A photo | Систематическое положение | Mechanism определения пола |
|---|---|---|---|
| Данио-рерио ( Danio rerio ) | Класс Лучепёрые рыбы ( Actinopterygii ), отряд Карпообразные ( Cypriniformes ) | На начальных этапах развития — мальковый гермафродитизм, механизм дальнейшего определения пола неизвестен [22] . | |
| Обыкновенная пецилия ( Xiphophorus maculatus ) | Класс Лучепёрые рыбы ( Actinopterygii ), отряд Карпозубообразные ( Cyprinodontiformes ) | Имеются половые хромосомы X, Y и W. При этом WY, WX и XX — самки, а YY и XY — самцы [22] . | |
| Зелёный меченосец ( Xiphophorus hellerii ) | Класс Лучепёрые рыбы ( Actinopterygii ), отряд Карпозубообразные ( Cyprinodontiformes ) | Способны менять пол. Присутствие более развитого самца вызывает созревание самок и подавляет созревание молодых самцов вблизи него [59] [60] . | |
| Обыкновенная менидия ( Menidia menidia ) | Класс Лучепёрые рыбы ( Actinopterygii ), отряд Атеринообразные ( Atheriniformes ) | Нерестятся с марта по июль. Если личинки развиваются при низкой температуре, то большинство особей становится самками. Если личинки развиваются при высокой температуре, то большинство особей становится самцами [61] . | |
| Золотистый спар ( Sparus aurata ) | Класс Лучепёрые рыбы ( Actinopterygii ), отряд Окунеобразные ( Perciformes ) | Молодые рыбы сначала нерестятся как самцы, в дальнейшем они могут менять пол на женский (протандрический гермафродитизм) [62] . | |
| Хирономус ( Chironomus ) (на фото — Chironomus plumosus ) | Класс Насекомые ( Insecta ), отряд Двукрылые ( Diptera ), семейство Комары-звонцы ( Chironomidae ) | У Chironomus нет половых хромосом как таковых, а политенные хромосомы одинаковы у самцов и самок и содержат участок, предположительно соответствующий Y-хромосоме. Пол же определяется сложным взаимодействием мужских и женских генов с участием генов-регуляторов [63] . | |
| Бугорчатая лягушка ( Rana rugosa ) | Отряд Бесхвостые ( Anura ) | Этот вид, обитающий в Японии , представлен двумя географически разобщёнными популяциями. В одной из этих популяций имеется XY-система определения пола, а в другой — ZW [64] . Считается, что ZW-система у этой лягушки возникла дважды и независимо [64] . | |
| Северная лейопельма ( Leiopelma hochstetteri ) | Отряд Бесхвостые ( Anura ) | Эндемик Новой Зеландии . Самцы имеют 22 аутосомы, а самки 22 аутосомы и одну W-хромосому. Эта W-хромосома крупнее аутосом, и количество гетерохроматина в ней варьирует в разных популяциях [65] . В одной популяции W вообще не найдена, и многие учёные рассматривают данную W-хромосому скорее не как половую, а как дополнительную В-хромосому, сохраняющуюся в кариотипе благодаря повышенной вероятности попадания в яйцеклетку и на которую случайно оказался перенесён ген-триггер пола. По другой версии, северная лейопельма просто утратила W-хромосому [65] . Как бы то ни было, такой механизм определения пола уникален среди животных [65] . | |
| Пауки ( Araneae ) (на фото — Araneus diadematus ) | Класс Паукообразные ( Arachnida ) | Y-хромосом нет, но зато имеется (в наиболее частом случае) две пары негомологичных Х-хромосом [66] . | |
| Австралийская ехидна ( Tachyglossus aculeatus ) | Отряд Однопроходные ( Monotremata ) | Как и у утконоса, у ехидны нет гена SRY, определяющего мужское начало у зверей, а гомолог человеческой X-хромосомы локализован в 16-й хромосоме ехидны [67] . У ехидны имеется 9 половых хромосом: 5 Х-хромосом и 4 Y-хромосом (Y-хромосомы имеются только у самцов). В профазе первого деления мейоза у ехидны образуется не 4 бивалента XY и один унивалент X, как можно было предположить, а единственный унивалент, хромосомы в котором конъюгируют по цепочке [68] . Это возможно потому, что плечи пяти Х и четырёх Y-хромосом гомологичны друг другом «со сдвигом» на одно плечо. |
Plants
В настоящее время считается, что системы определения пола у растений возникали множество раз и в относительно недавнее время от гермафродитных предков (в том числе и однодомных растений с раздельнополыми мужскими и женскими цветками ), то есть двудомные растения возникли от однодомных и растений с гермафродитными цветками [9] . Свидетельством этому может быть то, что, например, у некоторых двудомных растений, имеющих предков с гермафродитными цветками, в однополых цветках имеются рудименты половых органов противоположного пола. О том, что двудомность возникла недавно и независимо у различных групп растений, говорит её низкая распространённость и наличие у различных таксономически разобщённых групп растений. Системы половых хромосом у растений также возникали несколько раз в течение эволюции цветковых растений . В ходе неё возникло множество генов, определяющих пол, в том числе факторы мужской и женской стерильности , причём эти гены могут быть локализованы не только в ядре , но и в цитоплазме (например, у кукурузы известно явление цитоплазматической мужской стерильности ). Помимо цветковых, у других растений, например, мхов, также представляют интерес независимо появившиеся половые хромосомы [69] .
В отличие от большинства животных , проявление генетического определения пола у растений может в значительной мере изменяться под действием различных факторов внешней среды. Поэтому процесс формирования пола у растений подвержен большим колебаниям в процессе онтогенеза , чем у животных. Под действием различных факторов может происходить даже полное переопределение пола. Это связано с регуляторными процессами, обусловленными действием условий внешней среды, и внутренними изменениями метаболического характера [70] .
Генетическое определение пола у растений
Половые хромосомы растений
Gender-linked inheritance and sex chromosomes of plants are remarkably similar to those in animals, only differences between sex chromosomes in plants are not as pronounced as in animals [70] . In the vast majority of cases, males are heterozygous, or, if there are visible differences between the sex chromosomes, heterogametic (approximately half of the plants have a separation between the sexes [71] ). However, there are exceptions: for example, strawberries ( Fragaria ) and some other flowering homogametic sex are male [72] . The male genotype in the case of a heterogametic male should contain the dominant female fertility suppressor - Su F. Then, if Su F homozygotes are viable, self-pollination will result in 3: 1 cleavage (males: females), otherwise, cleavage will be 2: 1 [9] .
Like animals, plants X and Y are incapable of recombination . This prevents recombination between the genital loci , since recombination can lead to the appearance of defective, even completely sterile, individuals. It is assumed that the reason for the convergence of the genital loci (the crossover frequency is proportional to the distance between the loci) could be inversions and / or translocations [9] .
The evolution of the sex chromosomes of plants is closely related to the degeneration of the Y chromosome . Since, in comparison with animals, the plant Y-chromosome appeared relatively recently, we are able to observe the early stages of the Y-chromosome degeneration using their example. However, in some plants, the evolution of the Y chromosome is just beginning, and the fact of degeneration of this chromosome is controversial, but in the cases that have been most studied at the moment, in fact, some degeneration is shown. For example, in acid sorrel ( Rumex acetosa ), the Y chromosome consists of heterochromatin [73] [74] [75] . On the other hand, some transcriptional activity of this chromosome has been shown [73] , possibly due to the presence of scattered transcribed elements such as transposons , so that it is practically not involved in ensuring the active physiological processes of sorrel. There is incompletely verified data on the high frequency of chromosome rearrangements [76] and variability in the structure of the Y chromosome of this species [77] , which inevitably lead to the loss of part of the genetic material , as in the Y chromosome of animals. In some cases, mutations in the X chromosome of acidic sorrel are not covered by the Y chromosome [78] , thereby demonstrating the classic sex-linked inheritance observed in some animals. In other words, the Y chromosome is hemizygous in terms of genes located on the X chromosome . This fact also suggests that the Y chromosome has lost some of the genes inherent in its former homologue, the Y chromosome. Finally, in most species studied, YY homozygotes are not viable, although there are exceptions. However, the most basic point regarding the degeneration of the Y chromosome is the lack of recombination between it and the X chromosome. So if in plants, as in animals, the Y chromosome actually degenerates, then we can talk about the comprehensive nature of this process [9] .
Genetic mechanisms for determining sex in plants
Genetic mechanisms of sex determination in plants are very diverse [79] ; both sex chromosomes and autosomes are involved in them.
The following table gives examples of various mechanisms for determining sex in plants [72] :
| Plant | A photo | Systematic position | Mechanism sex determination |
|---|---|---|---|
| Spherocarpus ( Sphaerocarpus ) | Department of Hepatic Mosses ( Marchantiophyta ) | Male gametophyte 7A + Y, female 7A + X. After fertilization, the zygote and the diploid sporophyte developing from it contain 14A + XY or 14A + XX in males and females, respectively [80] . | |
| Ceratopteris richardii | Fern Division ( Pteridophyta ) | Equal spore fern. Disputes do not differ from each other, and each of them can potentially develop into a male, on which only anteridia are formed, or a hermaphrodite (monoecious) plant, which has both anteridia and archegonia . Sexual affiliation of the spore is determined by the pheromone A CE (from the English antheridiogen Ceratopteris ), secreted by a monoecious plant, growing near the place where the spore enters the ground (it directs development along the male path, in its absence a hermaphroditic plant develops) [79] . | |
| The dioecious stepworm ( Bryonia dioica ) | Pumpkin Family ( Cucurbitaceae ) | A dioecious plant with XY sex determination and homomorphic sex chromosomes [81] . The presence of the Y chromosome determines the development of the male body. | |
| Papaya ( Carica papaya ) | Family Caricaceae | There are two Y chromosomes: one determines the development of the male body (Y), the other determines the bisexual (Y h [82] ). Homozygotes for any Y chromosome are not viable [82] . | |
| Salt white ( Silene latifolia ) | Family Cloves ( Caryophyllaceae ) | Sex depends not only on the presence of sex chromosomes, but also on the activity of their individual sites. The Y chromosome contains regions I – IV, and the X chromosome contains V – VI. Section I blocks the development of carpels , and when it is inactivated for one reason or another, a hermaphroditic flower is formed. Sections II – IV of this chromosome are presumably responsible for the development of anthers and pollen grains . Section V of the X chromosome determines the development of the female parts of the flower. The Y chromosome is highly active, therefore, XXXY individuals have only male flowers, and only XXXXY have hermaphroditic flowers. In addition, in female plants affected by the fungus Ustilago violacea , a sex change to a male is possible [83] . | |
| Asparagus officinalis ( Asparagus officinalis ) | Asparagaceae Family | Males can have the XY and YY genotypes, so in asparagus the genes contained in the X chromosome are not vital. The male gender in this case behaves as a usual dominant trait, giving a 3: 1 cleavage in F 2 [84] . | |
| Mad Cucumber ( Ecballium elaterium ) | Pumpkin Family ( Cucurbitaceae ) | Sex is determined by three alleles of one gene: a D > a + > a d . a D determines male gender , a + - hermaphroditism, a d - female gender [85] . | |
| Sparrow Sorrel ( Rumex acetosella ) | Buckwheat Family ( Polygonaceae ) | The Y chromosome is inactive, sex is determined by the ratio of autosomes and X chromosomes [86] . |
Environmental Factors
As noted above, environmental factors are extremely important for determining sex in plants. It has been observed that certain factors cause feminization (female sexualization) or masculinization (male sexualization). The effect of feminizing factors in dicotyledons is especially strong. These factors are shown in the following table [72] [70] :
| Feminization Enhancing Factors | Factors Enhancing Masculinization |
|---|---|
| Low temperatures | High temperatures |
| Nitrogen compounds in the soil | Potassium compounds in the soil |
| Shortwave light | Long wave light |
| High humidity | Low humidity |
| Cytokinins , auxins [87] , ethylene | Gibberellins |
| Carbon Monoxide (CO) Treatment | Lack of CO |
The level of phytohormones in a plant is determined not only by the action of the external environment, but also by the correlative relationships between the organs of the plant, therefore, the removal of certain organs of the plant also affects the formation of sex. For example, the removal of hemp and spinach roots contributed to an increase in the number of male plants, and the removal of leaves contributed to an increase in the number of female individuals [70] .
The action of some phytohormones is determined as follows. The cytokinins formed in the roots , moving into the apex, include a program that determines the manifestation of the female sex ( pistillate flowers), while the gibberellins formed in the leaves include a program associated with masculinization ( staminate flowers) [70] .
Unicellular Eukaryotes
Protists (as well as unicellular organisms belonging to other kingdoms ) mainly reproduce asexually , switching to sexual reproduction only in adverse conditions. In addition, gametes as such ( eggs and sperm ) form far from all unicellular organisms, and only they can speak of the field in the typical sense (the female sex forms the eggs, the male sperm). More often, vegetative cells merge instead of gametes, and in ciliates, genetic information is exchanged between individuals without any merging of vegetative cells at all. It has been established that often each vegetative cell does not merge with any other vegetative cell, but only with cells of certain types. Therefore, in this case they are not talking about the field of cells, but about the types of mating , or sexual types [88] . Sometimes, among them, the male type is the donor of genetic information, and the female type is the recipient of the genetic information of the donor.
Protozoa
The most famous example of the sexual process in protozoa is conjugation in ciliates . In the simplest, the system of sexual types can be bipolar (for example, in the ciliates Paramecium aurelia , and the opposite sexual types are inherited as recessive ( rr ) and dominant ( Rr , RR ) and are controlled by alleles of one gene ). In addition, a tetrapolar system controlled by two genes ( Paramecium bursaria ), as well as an octopolar system controlled by three genes are possible (a difference in at least one of the three genes determines a separate sexual type). Cases of multiple sexual types are also known, while the sexual type can be determined by several genes as well as several alleles of one gene that dominate one another. Thus, the cetus Tetrahymena thermophila has seven types of mating, and the Euplotes - 12 [89] . Only cells of various sexual types can enter the sexual process [90] .
The molecular mechanism for determining the type of mating in Tetrahymena thermophila has recently been described. As described above, she has 7 sexual types, and for each of them there is a specific cassette containing MT genes (MTA and MTB) - genes encoding “mating proteins” (MT proteins). In the micronucleus of each ciliates, all seven cassettes are present, but only one of them, corresponding to the type of mating of the ciliates, has genes responsible for the attachment of MT proteins to the membrane . They are irreversibly removed from other cassettes [91] .
If in the micronucleus in one form or another there are all 7 cassettes, then in the macronucleus there is only one cassette corresponding to the sexual type of infusoria. The remaining cassettes are completely excluded. The mechanism of this exception is supposedly as follows. The missing DNA region , which determines the attachment of MT protein to the membrane, is transferred from cassette to cassette during homologous recombination or simply non-homologous connection of the ends . Cassettes giving away the missing area are cut out. The process lasts until there is only one cassette [91] .
In some amoeba , the phenomenon of paracopulation is described, in which two multinucleated individuals combine, merge completely and later divide into two. The genetics of this process has not yet been studied [92] .
Yeast
In yeast S. cerevisiae, vegetative budding cells are haploid and are ascospores ; during the sexual process , a zygote forms, which divides meiosis. It was established that S. cerevisiae has the HMR and HML genes that determine the pairing types a and α, respectively. They are located at different loci of the III chromosome. Both of them are inactive. The type of pairing is determined by the allele of the locus MAT - MAT a or MATα. Only cells with different types of mating can mate. This interaction is provided by specific pheromones that attract only cells of opposite types of pairing to each other. At the first divisions of the ascospore, a gender reversal occurs - the gene is replaced with another in the MAT locus by directed specific intrachromosomal conversion . This conversion is regulated by the HO gene product, a site-specific endonuclease , which breaks at the MAT locus, cutting out the allele located in it. In the gap formed, one of two inactive loci - HMR or HML - and sends its copy instead of the excised MAT allele. Such floor switching is carried out according to the type of cassette mechanism (silent cassettes HMR or HML serve as “cassettes”). It was proposed in the late 70's. XX century A. Herskowitz, J. Hicks, and J. Strasner [93] .
Information contained in cassettes is not expressed in haploid cells due to the presence of special sequences - silencers ( silencers ) that affect the nature of chromatin compaction in cassettes. Silencers are controlled by special SIR genes located on other chromosomes. There are no silencers near the MAT locus [93] .
Two proteins are read from the MATα allele (as well as copies of HML at the MAT locus) (due to alternative splicing ) - α1 activates the genes necessary for the development of the α-type mating phenotype; protein α2 suppresses the genes necessary for the development of the type of mating a . In the absence of α2 protein, mating type a develops. The MAT allele a encodes the synthesis of protein a1 , responsible for the manifestation of the type of pairing a .
In the zygote there are both MAT a and MATα. In it, protein a1 is read from MAT a. It inhibits the transcription of α1 protein mRNA (therefore, there are no signs of α-type mating in zygotes). Protein α2 continues to be read (therefore, the phenotype of the pairing type does not develop either). As a result, the zygote is sexless; it does not merge with other cells and does not secrete pheromones [94] . The combined action of proteins A1 and α2 includes the genes necessary for the passage of meiosis and the formation of spores.
A similar cassette mechanism was found in another type of yeast - Schiz. pombe [93] . Similar mechanisms for determining sex operate in some basidiomycetes [95] , but they have many alleles responsible for the sexual type, and not just two, and the number of mating types reaches several thousand [96] .
Algae
Algae are a fairly diverse group of plant organisms, among them there are both multicellular and unicellular representatives. The sexual processes occurring in algae are also diverse: isogamy , anisogamy (heterogamy), oogamy , hologamia and conjugation [97] . Only in the case of oogamy can we talk about the field, since only in this process the merging gametes noticeably differ both in size and shape. In other cases, the concept of “type of mating” is most applicable: the most primitive type of the reproductive process - hologamia — consists in the fusion of not specialized germ cells, but ordinary vegetative ones [97] ; with isogamy, identical outwardly gametes merge, but of different types of mating (opposite types of mating are “+” and “-”); anisogamy is accompanied by the fusion of identical in structure but different in size gametes (sometimes a larger gamete is called female, and a smaller gamete is called male) [98] . Finally, conjugation is accompanied by a fusion of the contents of two apparently similar vegetative cells [99] .
Наиболее изученной водорослью, чей половой процесс протекает в форме изогамии, является хламидомонада Chlamydomonas reinhardtii . Её жизненный цикл включает несколько этапов, причём редукция числа хромосом происходит при первом делении зиготы, то есть вегетативные клетки гаплоидны [100] .
Тип спаривания вегетативной клетки определяется наличием у неё одной из двух аллелей локуса MT, ответственного за тип спаривания. Различают аллели MT + и MT - , определяющие тип спаривания «+» и «-» соответственно. У обоих типов спаривания локус MT претерпел несколько крупных инверсий и транслокаций, препятствующих возможной рекомбинации в этом локусе. Вдобавок к перестройкам, MT + содержит 3 участка ДНК и два тандемно повторяющихся гена ( Ezy2 и OTU2 ), отсутствующих в MT - . В то же время MT - тоже содержит 3 участка, отсутствующих в MT + . Гены, содержащиеся в регионах FUS1, MTD1 и MID, обусловливают специфичные функции локуса MT при гаметогенезе и оплодотворении [100] .
После оплодотворения и завершения кариогамии , то есть слияния ядер, в новой зиготе запускаются специфичные для зиготы гены, благодаря активности которых хламидомонада переживает неблагоприятные условия (а к половому размножению хламидомонада переходит только при ухудшении условий внешней среды, точнее, при понижении содержания азота во внешней среде), в частности, новая зигота окружается плотной клеточной стенкой. При улучшении условий зигота делится мейозом , давая начало четырём гаплоидным вегетативным клеткам [100] .
Подобный механизм определения пола (на основе локуса MT) встречается и у видов, имеющих другие формы полового процесса — анизогамию и оогамию. В частности, это касается родственников хламидомонады — вольвоксовых водорослей [101] : гониума [102] , вольвокса [103] , пандорины [104] , эвдорины и др. Однако если у хламидомонады имеется достаточно примитивная форма полового процесса [98] , то в дальнейшем её изогамия эволюционирует в анизогамию [98] пандорины. Наконец, у вольвокса имеется наиболее высокоорганизованная форма полового процесса — оогамия [101] .
Грибы
Хотя у большинства организмов имеется только два различных половых типа , среди грибов имеются представители, число типов спаривания у которых доходит до нескольких тысяч. Установлено, что у грибов имеется две основных системы половых типов: биполярная и тетраполярная. В случае биполярной системы половой тип определяется единственным локусом MAT, имеющем два альтернативные формы — a и α (их называют идиоморфами ). Виды с биполярной системой обнаружены среди аскомицетов , базидиомицетов и зигомицетов , что доказывает то, что именно эта система явилась предковой для тетраполярной. У многих базидиомицетов имеется тетраполярная система, при которой имеется два несвязанных локуса, определяющих тип спаривания. Один локус кодирует гомеодоменные транскрипционные факторы , а другой отвечает за феромоны и рецепторы к феромонам. Для совместимости двух организмов оба эти локуса должны различаться, поэтому отдельный тип спаривания может быть несовместим не только с самим собой, как у инфузорий, но и с некоторыми другими типами спаривания (например, у навозника ( Coprinus ) возможно 48 совместимых вариантов и 16 несовместимых) [105] . У многих видов эти локусы имеют множество аллелей , благодаря чему у них имеются тысячи половых типов. Во многих независимых случаях происходил переход от тетраполярной системы к биполярной, в некоторых случаях из-за слияния двух несвязанных половых локусов в один участок. Возможно, это иллюстрирует то, что эволюционный отбор ограничивает число половых типов/полов до двух [106] .
У многих описанных на данный момент грибов половой процесс не описан (их относят к группе несовершенных грибов). Тем не менее, у многих из них показано наличие локуса типа спаривания и механизм, необходимый для спаривания и мейоза. В некоторых случаях, кроме этого, выявлено равное распространение противоположных типов спаривания в природе и доказана рекомбинация. Поэтому, вероятно, существует небольшая группа действительно бесполых грибов, у многих же (и, возможно, большинства) половой процесс протекает скрытно и его ещё предстоит описать [106] .
Бактерии
Конъюгацией у бактерий называется непосредственный контакт между клетками бактерий, сопровождаемый переносом генетического материала из клеток донора в клетки реципиента. Клетки донора при этом называют мужскими и обозначают F + , реципиент же называют женской клеткой (F - ) [107] .
Установлено, что за перенос генетического материала у E. coli ответственна F-плазмида . Имеющие её клетки, то есть мужские клетки, имеют несколько изменённый фенотип : на их поверхности имеются так называемые половые пили , по-видимому, необходимые для удержания клеток вместе во время конъюгации [108] . Кроме того, на половых пилях адсорбируются некоторые бактериофаги [109] , так что вместе с половой плазмидой клетка получает и устойчивость к ним.
При конъюгации реципиент получает только одну цепь плазмиды, которую впоследствии и донор, и реципиент достраивают до двойной цепи [107] .
F-плазмида может интегрировать в бактериальную хромосому . При этом образуются так называемые клетки Hfr ( англ. High frequency recombination ). При их конъюгации с клетками F - F-плазмида очень редко передаётся реципиенту и он сохраняет свойства F - -клетки, но зато он получает значительную долю (а в некоторых случаях — и целый геном ) генов клетки Hfr . Это повышает частоту появления рекомбинантов и делает Hfr высокоэффективным донором [107] .
Интегрированная плазмида может исключаться из хромосомы, вновь давая клетки типа F + . Но в некоторых случаях подобное вырезание происходит с ошибкой, и тогда участок собственно бактериальной хромосомы замечает участок фактора F. При этом образуется F'-(F-прим) фактор, который может переносит бактериальные гены независимо от хромосомы, но вместе с F-плазмидой. Это явление называется сексдукцией [107] .
Описанные выше процессы приводят к рекомбинации генетического материала у прокариот , что может повышать, например, их устойчивость к антибиотикам и приводить к появлению новых фенотипических свойств у клеток, ранее их не имевших.
Определение пола у млекопитающих и человека
У млекопитающих, в том числе и человека, развитие мужского организма невозможно без наличия Y-хромосомы, то есть прежде всего половая принадлежность у человека определяется сочетанием половых хромосом в его кариотипе. Однако установлено, что для развития организма мужского пола недостаточно только наличия гена SRY на Y-хромосоме, который определяет дифференцировку мужских половых желёз и синтез ими тестостерона . Ткани -мишени, на которые действует тестостерон, должны быть чувствительны к нему. Для этого необходим белок - рецептор , являющийся продуктом особого гена , локализованного в Х-хромосоме (локус Xq11-Xq12) [110] . Он обеспечивает проникновение гормона в клетки нужных тканей. Если в этом гене происходит мутация , нарушающая образование нормального белка-рецептора, то ткани-мишени становятся нечувствительны к тестостерону. Не использовав возможность формирования мужского фенотипа на определённом этапе онтогенеза, организм осуществляет развитие по женскому типу. В итоге формируется особь с кариотипом XY, но внешне схожая с женщиной. Такие субъекты бесплодны, поскольку их семенники недоразвиты, а выводные протоки нередко формируются по женскому типу (недоразвитая матка , влагалище ). Вторичные половые признаки характерны для женского пола. Такое нарушение у человека известно как синдром Морриса [111] . Таким образом, пол у человека формируется как результат комплементарного взаимодействия неаллельных генов [112] .
Зародыши млекопитающих развиваются по пути самки, если организм не содержит яичек, в противоположном случае, зародыш развивается по пути самца. В случае, если половые железы удалены до формирования яичек или яичников, организм также развивается в самку, независимо от того, какие хромосомы содержит геном. Для развития женских половых органов требуются и другие факторы, например, яичники млекопитающих не развиваются без сигнального белка Wnt4 . [113]
Введение гена Sry в геном ХХ-зиготы мыши приводит к развитию зародыша по пути самца, хотя остальные гены Y-хромосомы у такого эмбриона отсутствуют. Подобные мыши с «обращенным полом» не способны к сперматогенезу, так как их геном не содержит других генов Y-хромосомы, которые необходимы для образования спермы. Ген Sry экспрессируется в соматических клетках развивающихся половых желез и вызывает их дифференцировку этих клеток в клетки Сертоли. Последние направляют развитие организма по мужскому пути, в том числе, стимулируют превращение клеток яичка в клетки Лейдига, секретирующие тестостерон в кровь [113] .
Белок Sry связывает соответствующие участки ДНК и запускает транскрипцию других генов, принимающих участие в формировании клеток Сертоли. Одним из важных генов, активируемых Sry, является ген Sox9, который экспрессируется у всех самцов позвоночных. В отсутствие генов Sry или Sox9, у XY-зародышей млекопитающих вместо яичек формируются яичники, а вместо клеток Сертоли формируются фолликулярные клетки. Остальные клетки половых желез вместо клеток Лейдига превращаются в клетки теки, которые, в пубертатный период начинают секретировать эстроген [113] .
See also
- Соотношение полов
- Механизм определения пола у человека
- Геномный импринтинг
- Wolbachia
Notes
- ↑ 1 2 Коряков, Жимулёв, 2009 , с. 122—125.
- ↑ 1 2 Асланян, Солдатова, 2010 , с. 23—26.
- ↑ Билич, Крыжановский, 2009 , с. 767—775.
- ↑ T Ramakrishna Rao. The Secret Sex Lives of Rotifers: Sex, Asex and Cannibalism // RESONANCE. — 2000.
- ↑ King RC; Stansfield WD; Mulligan PK A Dictionary of Genetics. — 7th. — Oxford, 2006. — P. 204.
- ↑ Gilbert SF Chromosomal Sex Determination in Mammals // Developmental Biology. — 6th. — Sunderland (MA): Sinauer Associates, 2000. — ISBN 0-87893-243-7 .
- ↑ Daisuke Kageyama, Satoko Narita, Masaya Watanabe. Insects sex determination is manipulated by their endosymbionts: incidences, meschanisms and implications // Insects. - 2012. - No. 3 . — С. 161—199 . — ISSN 2075-4450 . — DOI : 10.3390/insects3010161 .
- ↑ 1 2 Robert H. Devlin, Yoshitaka Nagahama. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences // Aquaculture. — 2002. — № 208 . — С. 191—364 .
- ↑ 1 2 3 4 5 D. Charlesworth. Plant sex determination and sex chromosomes // Heredity. — 2002. — № 88 . — С. 94—101 . — DOI : 10.1038/sj.hdy.6800016 .
- ↑ Perspectives on genetics: anecdotal, historical, and critical commentaries, 1987–1998 / James Franklin Crow, William F. Dove. — Madison, WI : University of Wisconsin Press, 2000. — ISBN 978-0-299-16604-5 .
- ↑ Коряков, Жимулёв, 2009 , с. 125—130.
- ↑ Бородин П. М., Башева Е. А., Голенищев Ф. Н. Взлёт и падение Y-хромосомы. Природа; 2012; № 1: С.45-50 ( http://evolution2.narod.ru/y.pdf (недоступная ссылка) )
- ↑ van Doorn GS, Kirkpatrick M. Transitions Between Male and Female Heterogamety Caused by Sex-Antagonistic Selection. Genetics 2010; 186(2): 629—645. PMID 20628036
- ↑ Попадьин К. Ю., Мамирова Л. А. История одинокой хромосомы (рус.) // Природа . — Наука , 2004. — № 9 . — С. 11—16 .
- ↑ 1 2 Graves JA The origin and function of the mammalian Y chromosome and Y-borne genes--an evolving understanding (англ.) // Bioessays : journal. — 1995. — April ( vol. 17 , no. 4 ). — P. 311—320 . — DOI : 10.1002/bies.950170407 . — PMID 7741724 .
- ↑ Namekawa, Satoshi. XY and ZW: Is Meiotic Sex Chromosome Inactivation the Rule in Evolution? (англ.) : journal. — Public Library of Science, 2009. — Vol. 5 , no. 5 . — P. 3 . — DOI : 10.1371/journal.pgen.1000493 .
- ↑ 1 2 3 4 Vallender, Eric, Bruce T. Lahn. Multiple independent origins of sex chromosomes in amniotes (англ.) : journal. — Proceedings of the National Academy of Sciences, 2006. — 28 November ( vol. 103 , no. 5 ). — DOI : 10.1073/pnas.0608879103 . — PMID 17116892 .
- ↑ Graves, Jennifer. Sex Chromosome Specialization and Degeneration in Mammals (англ.) // Cell : journal. — Cell Press , 2006. — 10 March ( vol. 124 , no. 5 ). — P. 901—914 . — DOI : 10.1016/j.cell.2006.02.024 . — PMID 16530039 .
- ↑ University of Chicago Medical Center (28 October 1999). The evolution of the sex chromosomes: Step by step . Press release . Проверено 23 October 2011 .
- ↑ Charlesworth, Brian. The organization and evolution of the human Y chromosome (англ.) // BioMed Central : journal. — 2003. — 14 August ( vol. 4 , no. 9 ). — P. 226 . — DOI : 10.1186/gb-2003-4-9-226 . — PMID 12952526 .
- ↑ Асланян, Солдатова, 2010 , с. 32—33.
- ↑ 1 2 3 4 5 Schartl, Manfred. A comparative view on sex determination in medaka (англ.) // Mechanisms of Development : journal. — 2004. — July ( vol. 121 , no. 7—8 ). — P. 639—645 . — DOI : 10.1016/j.mod.2004.03.001 .
- ↑ Асланян, Солдатова, 2010 , с. 36—41.
- ↑ Inge-Vechtomov, 2010 , p. 155.
- ↑ 1 2 3 4 5 Hake, Laura. Genetic Mechanisms of Sex Determination (неопр.) // Nature Education. — 2008. — Т. 1 , № 1 .
- ↑ Goodfellow, PN DAX-1, an 'antitestis'gene (англ.) // Cellular and Molecular Life Sciences : journal. - 1999. - Vol. 55 . — P. 857—863 . — DOI : 10.1007/PL00013201 . — PMID 10412368 .
- ↑ 1 2 Chandra, HS Another way of looking at the enigma of sex determination in Ellobius lutescens (англ.) // Current Science : journal. — 1999. — 25 April ( vol. 76 , no. 8 ). — P. 1072 .
- ↑ Cox, James J. A SOX9 Duplication and Familial 46,XX Developmental Testicular Disorder (англ.) // New England Journal of Medicine : journal. — 2011. — 6 January ( vol. 364 ). — P. 91—93 .
- ↑ Huang, Bing. Autosomal XX sex reversal caused by duplication of SOX9 (англ.) // American Journal of Medical Genetics : journal. — 1999. — 7 December ( vol. 87 , no. 4 ). — P. 349—353 .
- ↑ Uhlenhaut, Henriette N. Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation (англ.) // Cell : journal. — Cell Press , 2009. — 11 December ( vol. 139 ). — P. 1130—1142 . — DOI : 10.1016/j.cell.2009.11.02 .
- ↑ Warren, WC; Hillier, Ladeana W.; Marshall Graves, Jennifer A.; Birney, Ewan; Ponting, Chris P.; Grützner, Frank; Belov, Katherine; Miller, Webb; Clarke, Laura. Genome analysis of the platypus reveals unique signatures of evolution (англ.) // Nature : journal. - 2008. - Vol. 453 , no. 7192 . — P. 175—U1 . — DOI : 10.1038/nature06936 . — PMID 18464734 .
- ↑ Шевченко А. И., Захарова И. С., Закиян С. М. Эволюционный путь процесса инактивации Х-хромосомы у млекопитающих // Acta Naturae. — 2013. — Т. 5 , № 2 . — С. 40—54 . (inaccessible link)
- ↑ Warren, Wesley C. Genome analysis of the platypus reveals unique signatures of evolution (англ.) // Nature : journal. — 2008. — 8 May ( vol. 453 , no. 7192 ). — P. 175—183 . — DOI : 10.1038/nature06936 .
- ↑ Gruetzner, F., T. Ashley, DM Rowell, and JAM Graves. Analysis of the platypus reveals unique signatures of evolution (англ.) // Chromosoma : journal. - 2006. - Vol. 115 , no. 2 . — P. 75—88 . — DOI : 10.1007/s00412-005-0034-4 . — PMID 16344965 .
- ↑ Kuroiwa A., Handa S., Nishiyama C., Chiba E., Yamada F., Abe S., Matsuda Y. Additional copies of CBX2 in the genomes of males of mammals lacking SRY, the Amami spiny rat ( Tokudaia osimensis ) and the Tokunoshima spiny rat ( Tokudaia tokunoshimensis ). (англ.) // Chromosome Res : journal. — 2011. — 8 June ( vol. 19 ). — P. 635—644 . — DOI : 10.1007/s10577-011-9223-6 . — PMID 21656076 .
- ↑ 1 2 3 Majerus, 2003 , p. 60.
- ↑ Patricia E. Kuwabara, Peter G. Okkema, Judith Kimble. tra-2 Encodes a Membrane Protein and May Mediate Cell Communication in the Caenorhabditis elegans Sex Determination Pathway (англ.) // Molecular Biology of the Cell : journal. — 1992. — April ( vol. 3 , no. 4 ). — P. 461—473 . — PMID 1498366 .
- ↑ Smith CA, Roeszler KN, Ohnesorg T., et al. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken (англ.) // Nature : journal. — 2009. — September ( vol. 461 , no. 7261 ). — P. 267—271 . — DOI : 10.1038/nature08298 . — PMID 19710650 .
- ↑ Stiglec R., Ezaz T., Graves JA A new look at the evolution of avian sex chromosomes (англ.) // Cytogenetic and Genome Research : journal. — Karger Publishers , 2007. — Vol. 117 , no. 1—4 . — P. 103—109 . — DOI : 10.1159/000103170 . — PMID 17675850 .
- ↑ Grützner, F.; Rens, W., Tsend-Ayush, E., El-Mogharbel, N., O'Brien, PCM, Jones, RC, Ferguson-Smith, MA and Marshall, JA In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes (англ.) // Nature : journal. - 2004. - Vol. 432 , no. 7019 . — P. 913—917 . — DOI : 10.1038/nature03021 . — PMID 15502814 .
- ↑ Virgin births for giant lizards , BBC News (20 декабря 2006). Дата обращения 13 марта 2008.
- ↑ W. Trauta, K. Saharab, F. Marecc. Sex Chromosomes and Sex Determination in Lepidoptera. Sex Dev 2007;1:332-346 (DOI: 10.1159/000111765)
- ↑ Genetic Mechanisms of Sex Determination | Learn Science at Scitable
- ↑ Handbuch D Zoologie Bd 4/36 Kristensen:lepidoptera 2 Ae - Google Books . Дата обращения 30 апреля 2013.
- ↑ 1 2 3 King RC; Stansfield WD and Mulligan PK 2006. A dictionary of genetics . 7th ed, Oxford University Press, p194. ISBN 0-19-530761-5
- ↑ Edward O. Wilson. Kin selection as the key to altruism: its rise and fall. (англ.) // Social Research : journal. — 2005. — 12 September ( vol. 72 ). — P. 1—8 .
- ↑ Ellen van Wilgenburg. Single locus complementary sex determination in Hymenoptera: an "unintelligent" design? (англ.) // BioMed Central : journal. — 2006. — 5 January ( vol. 3 , no. 1 ). — DOI : 10.1186/1742-9994-3-1 .
- ↑ 1 2 3 4 Гилберт С. Биология развития: В 3-х т. Т. 3: Пер. from English — М.: Мир, 1995. — с. 254.
- ↑ 1 2 Göth, Ann; Booth, David T. Temperature-dependent sex ratio in a bird (англ.) // Biology Letters : journal. — Royal Society Publishing , 2005. — March ( vol. 1 ). — P. 31—33 . — DOI : 10.1098/rsbl.2004.0247 . — PMID 17148121 .
- ↑ 1 2 Maldonado, LC Torres; A. Landa Piedra, N. Moreno Mendoza, A. Marmolejo Valencia. Expression profiles of Dax1, Dmrt1, and Sox9 during temperature sex determination in gonads of the sea turtle Lepidochelys olivacea (англ.) // General and Comparative Endocrinology : journal. — 2002. — 20 August ( vol. 129 ). — P. 20—26 . (inaccessible link)
- ↑ 1 2 3 Ferguson MWJ, Joanen T. (1982) Temperature of egg incubation determines sex in Alligator mississippiensis , Nature, 296 , 850—853.
- ↑ 1 2 Valenzuela, Nicole; Fredric J. Janzen. Nest-site philopatry and the evolution of temperature-dependent sex determination (англ.) // Evolutionary Ecology Research : journal. - 2001. - Vol. 3 . — P. 779—794 .
- ↑ 1 2 Apple snail: reproductive system .
- ↑ 1 2 3 Kiran Rasal; Makwana Nayan; Amar Gaikwad; Rashmi Ambulkar. Sex-Determination System In Fishes .
- ↑ Echiurans: Echiura - Echiurans And People .
- ↑ Inge-Vechtomov, 2010 , p. 528.
- ↑ Watts, Phillip C.; Kevin R. Buley, Stephanie Sanderson, Wayne Boardman, Claudio Ciofi & Richard Gibson. Parthenogenesis in Komodo dragons (англ.) // Nature. — 2006. — 21 December ( vol. 444 ). — P. 1021—1022 . — DOI : 10.1038/4441021a . — PMID 17183308 .
- ↑ Jiggens, Francis M.; Gregory DD Hurst and Michael EN Majerus. Sex-ratio-distorting Wolbachia causes sex-role reversal in its butterfly host (англ.) // Proceedings of the Royal Society : journal. — 2000. — January ( vol. 267 , no. 1438 ). — P. 69—73 . — DOI : 10.1098/rspb.2000.0968 .
- ↑ In the science of sexual attraction, size matters , Yahoo! Science News , Yahoo! Inc (13 февраля 2007). Дата обращения 14 июня 2013.
- ↑ Choi, Charles Q. . Male Bling Makes Female Fish Mature Faster , LiveScience Animaldomain , Imaginova Corp. (13 февраля 2007). Дата обращения 14 февраля 2007.
- ↑ Conover, DO, Kynard, BE Environmental sex determination: interaction of temperature and genotype in a fish (англ.) // Science : journal. — 1981. — Vol. 213, no. 4507 . — P. 577—579.
- ↑ Rafaella Franch, Bruno Louro, Matina Tsalavouta, Dimitris Chatziplis, Costas S. Tsigenopoulos, Elena Sarropoulou, Jenny Antonello, Andonis Magoulas, Constantinos C. Mylonas, Massimiliano Babbucci, Tomaso Patarnello, Deborah M. Power, Giorgos Kotoulas, Luca Bargelloni. A Genetic Linkage Map of the Hermaphrodite Teleost Fish Sparus aurata L. // Genetics Society of America. — 2006. — DOI : 10.1534/genetics.106.059014 .
- ↑ The Unusual Sex Determination System of Chironomus .
- ↑ 1 2 M. Ogata, Y. Hasegawa, H. Ohtan, M. Mineyama, I. Miura. The ZZ/ZW sex-determining mechanism originated twice and independently during evolution of the frog, Rana rugosa // Heredity. — 2008. — № 100 . — С. 92—99 .
- ↑ 1 2 3 David M. Green. Cytogenetics of the endemic New Zealand frog, Leiopelma hochstetteri : extraordinary supernumerary chromosome variation and a unique sex-chromosome system // Chromosoma : journal. — 1988. — Vol. 97, № 1 . — P. 55—70. — DOI : 10.1007/BF00331795 .
- ↑ Leticia Aviles, Wayne Maddison. WHEN IS THE SEX RATIO BIASED IN SOCIAL SPIDERS?: CHROMOSOME STUDIES OF EMBRYOS AND MALE MEIOSIS IN ANELOSIMUS SPECIES (ARANEAE, THERIDIIDAE) // The Journal of Arachnology. — 1991. — № 19 . — С. 126—135 .
- ↑ MC Wallis, PD Waters, ML Delbridge, PJ Kirby, AJ Pask, F. Grützner, W. Rens, MA Ferguson-Smith, JAM Graves. Sex determination in platypus and echidna: autosomal location of SOX3 confirms the absence of SRY from monotremes // Chromosome Research. — 2007. — № 15(8) . — С. 949—959 . — ISSN 1573-6849 . — DOI : 10.1007/s10577-007-1185-3 .
- ↑ Willem Rens, Patricia CM O'Brien, Frank Grützner, Oliver Clarke, Daria Graphodatskaya, Enkhjargal Tsend-Ayush, Vladimir A Trifonov1, Helen Skelton, Mary C Wallis1, Steve Johnston, Frederic Veyrunes, Jennifer AM Graves, Malcolm A Ferguson-Smith. The multiple sex chromosomes of platypus and echidna are not completely identical and several share homology with the avian Z (англ.) // BioMed Central . — 2007. — No. 8 . — DOI : 10.1186/gb-2007-8-11-r243 .
- ↑ Okada S., Sone T., Fujisawa M., Nakayama S., Takenaka M., Ishizaki К., et al. The Y chromosome in the liverwort Marchantia polymorpha has accumulated unique repeat sequences harboring a male-specific gene // Proc Natl Acad Sci USA. — 2001. — № 98 . — С. 9454—9459 .
- ↑ 1 2 3 4 5 Физиология растений: определение пола у растений .
- ↑ Westergaard, M. The mechanism of sex determination in dioecious plants. // Adv Genet. — 1958. — № 9 . — С. 217—281 .
- ↑ 1 2 3 Билич, Крыжановский, 2009 , с. 777—781.
- ↑ 1 2 Clark MS, Parker JS, Ainsworth CC Repeated DNA and heterochromatin structure in Rumex acetosa // Heredity. — 1993. — № 70 . — С. 527—536 .
- ↑ Réjon CR, Jamilena M., Ramos MG, Parker JS, Rejon MR Cytogenetic and molecular analysis of the multiple sex-chromosome system of Rumex acetosa. // Heredity. — 1994. — № 72 . — С. 209—215 .
- ↑ Lengerova M., Vyskot B. Sex chromatin and nucleolar analyses in Rumex acetosa L. // Protoplasma. — 2001. — № 217 . — С. 147—153 .
- ↑ Wilby AS, Parker JS Mendelian and non-Mendelian inheritance of newly-arisen chromosome rearrangements. // Heredity. — 1988. — № 60 . — С. 263—268 .
- ↑ Wilby AS, Parker JS Continuous variation in Y-chromosome structure of Rumex acetosa. // Heredity. — № 57 . — С. 247—254 .
- ↑ Smith BW The mechanism of sex determination in Rumex hastatulus. (Eng.) // Genetics. — 1963. — P. 1265—1288 .
- ↑ 1 2 Cristina Juarez, Jo Ann Banks. Sex determination in plants // Current Opinion in Plant Biology. — 1998. — № 1 . — С. 68—72 . — ISSN 1369-5266 .
- ↑ Dale H. Vitt. Sex determination in mosses // The Michigan Botanist. — 1968. — С. 195—293 .
- ↑ Stefanie M. Volz. Evolution of dioecy in the Cucurbitaceae genus Bryonia — a phylogenetic, phylogeographic, and SCAR-marker approach . — 2008.
- ↑ 1 2 Ray Minga, Qingyi Yu, Paul H. Moore. Sex determination in papaya // Seminars in Cell & Developmental Biology. — 2007. — № 18 . — С. 401—408 .
- ↑ CP Scutt, T. Li, SE Robertson, ME Willis, PM Gilmartin. Sex determination in dioecious Silene latifolia. Effects of the Y chromosome and the parasitic smut fungus (Ustilago violacea) on gene expression during flower development. (англ.) // Plant Physiology . — American Society of Plant Biologists , 1997. — No. 114 . — P. 969—979 .
- ↑ Charles M. Rick, GC Hanna. Determination of Sex in Asparagus officinalis L. (англ.) // American Journal of Botany . — Botanical Society of America , 1943. — No. 30(9) . — P. 711—714 .
- ↑ Fernando Galán. Sex determination and phenogenetic in Ecballium elaterium (L.) Richard. The sexual inflorescence type on the stem .
- ↑ RB Singh, Ben W. Smith. The mechanism of sex determination in Rumex acetosella // Theoretical and Applied Genetics. — 1971. — № 41(8) . — С. 360—364 . — ISSN 1432-2242 . — DOI : 10.1007/BF00277336 .
- ↑ Stephen L. Dellaporta, Alejandro Calderon-Urrea. Sex Determination in Flowering Plants // The Plant Cell. — 1993. — № 5 . — С. 1241—1251 . Архивировано 5 августа 2014 года.
- ↑ Inge-Vechtomov, 2010 , p. 233.
- ↑ Элементы: Как инфузория тетрахимена выбирает себе пол .
- ↑ Inge-Vechtomov, 2010 , p. 233-234.
- ↑ 1 2 Marcella D. Cervantes, Eileen P. Hamilton, Jie Xiong, Michael J. Lawson, Dongxia Yuan, Michalis Hadjithomas, Wei Miao, Eduardo Orias. Selecting One of Several Mating Types through Gene Segment Joining and Deletion in Tetrahymena thermophila // PLoS Biology. — 2013. — № 11 . — DOI : 10.1371/journal.pbio.1001518 .
- ↑ Inge-Vechtomov, 2010 , p. 238.
- ↑ 1 2 3 Инге-Вечтомов, 2010 , с. 518—520.
- ↑ Yeast Mating Type Switching .
- ↑ Jacques Labarère, Thierry Noel. Mating type switching in teterapolar basidiomycete Agrocybe aegerita // Genetics society of America. - 1992.
- ↑ Lorna A. Casselton, Natalie S. Olesnicky. Molecular Genetics of Mating Recognition in Basidiomycete Fungi // Microbiology and molecular biology reviews. — 1998. — № 62 .
- ↑ 1 2 Биология размножения водорослей .
- ↑ 1 2 3 Hiroyuki Matsuda, Peter A. Abrams. Why are equally sized gametes so rare? The instability of isogamy and the cost of anisogamy // Evolutionary Ecology Research. — 1999. — № 1 . — С. 769—784 . (inaccessible link)
- ↑ Конъюгация — статья из Большой советской энциклопедии .
- ↑ 1 2 3 Ursula Goodenough, Huawen Lin, Jae-Hyeok Lee. Sex determination in Chlamydomonas // Seminars in Cell & Developmental Biology. — 2007. — № 18 . — С. 350—361 .
- ↑ 1 2 James G. Umen. Evolution of sex and mating loci: An expanded view from Volvocine algae // Curr Opin Microbiol.. — 2011. — № 14(6) . — С. 634—641 . — DOI : 10.1016/j.mib.2011.10.005 . (inaccessible link)
- ↑ Hamaji, T., Ferris, PJ, Coleman, AW, Waffenschmidt, S., Takahashi, F., Nishii, I., & Nozaki, H. Identification of the minus-dominance gene ortholog in the mating-type locus of Gonium pectoral (англ.) // Genetics : journal. - 2008. - Vol. 178 , no. 1 . — P. 283—294 . — DOI : 10.1534/genetics.107.078618 .
- ↑ Ferris, PJ, Olson, B., de Hoff, PL, Douglass, S., Casero, D., Prochnik, SE, Geng, S., et al. Evolution of an expanded sex-determining locus in Volvox (англ.) // Science : journal. - 2010 .-- Vol. 328 , no. 5976 . — P. 351—354 . — DOI : 10.1126/science.1186222 . — PMID 20395508 .
- ↑ Smith, GM. Phytoplankton of Inland Lakes of Wisconsin, Part I, Wisconsin Geological and Natural History Survey, Madison, WI. (1920).
- ↑ Ursula Kües, Lorna A. Casselton. The origin of multiple mating types in mushrooms (англ.) // Journal of Cell Science . — The Company of Biologists , 1993. — No. 104 . — P. 227—230 .
- ↑ 1 2 Banu Metin, Keisha Findley, Joseph Heitman. The Mating Type Locus (MAT) and Sexual Reproduction of Cryptococcus heveanensis: Insights into the Evolution of Sex and Sex-Determining Chromosomal Regions in Fungi .
- ↑ 1 2 3 4 Инге-Вечтомов, 2010 , с. 241—250.
- ↑ Langmuir. 2008 Jun 1;24(13):6796-802. Epub 2008 Jun 4. Evidence of DNA transfer through F-pilus channels during Escherichia coli conjugation. Shu AC, Wu CC, Chen YY, Peng HL, Chang HY, Yew TR.
- ↑ Bacteriophage ecology / Staphen T. Abedon. — Cambridge. — P. 7. — 464 p.
- ↑ Brown CJ, Goss SJ, Lubahn DB, Joseph DR, Wilson EM, French FS, Willard HF Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism (англ.) // Am. J. Hum. Genet. : journal. — 1989. — February ( vol. 44 , no. 2 ). — P. 264—269 . — PMID 2563196 .
- ↑ Galani A., Kitsiou-Tzeli S., Sofokleous C., Kanavakis E., Kalpini-Mavrou A. Androgen insensitivity syndrome: clinical features and molecular defects (англ.) // Hormones (Athens) : journal. - 2008. - Vol. 7 , no. 3 . — P. 217—229 . — PMID 18694860 .
- ↑ Ярыгин В.Н., Васильева В.И., Волков И.Н., Синельщикова В.В. Биология. В 2 кн. / Ярыгин В.Н.. — М. : Высшая школа, 2010. — Т. 1. — С. 159—160. — 432 с.
- ↑ 1 2 3 Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter. Molecular Biology of the Cell. — 5. — Garland Science, 2008. — 1392 с. — ISBN 0815341059 .
Literature
- Асланян М. М., Солдатова О. П. Генетика и происхождение пола. Учебное пособие для студентов, обучающихся по направлению «биология». — М. : Авторская академия; Товарищество научных изданий КМК, 2010. — 114 с. — ISBN 978-5-91902-001-1 .
- Билич Г. Л., Крыжановский В. А. Биология. Полный курс: в 4 т. 5-е изд. Т. 1. — М. : Оникс, 2009. — 864 с. — ISBN 978-5-488-02311-6 .
- Инге-Вечтомов С. Г. Генетика с основами селекции. - SPb. : Publishing house NL, 2010. - 718 p. — ISBN 987-5-94869-105-3.
- Коряков Д. Е., Жимулёв И. Ф. Хромосомы. Структура и функции. — Новосибирск: Изд-во СО РАН, 2009. — 258 с. — ISBN 978-5-7692-1045-7 .
- Majerus M. E. N. Sex Wars: Genes, Bacteria, and Biased Sex Ratios . — Princeton: Princeton University Press, 2003. — xxi + 250 p. — ISBN 0-691-00981-3 .
Links
- Боголюбова, Аполлинария. Что такое пол? . // Сайт Biomolecula.ru (15 апреля 2014). Дата обращения 31 марта 2018.
- Ястребова, Светлана. Мальчики налево, девочки направо... А остальные? . // Сайт Biomolecula.ru (19 мая 2015). Дата обращения 31 марта 2018.
- Кондратенко, Юлия. Зачатий мальчиков происходит столько же, сколько зачатий девочек . // Сайт Biomolecula.ru (28 апреля 2015). Дата обращения 31 марта 2018.
- Лебедев, Виктор. Мальчик или девочка? . // Сайт Biomolecula.ru (3 июня 2016). Дата обращения 31 марта 2018.
- Лебедев, Виктор. Женский взгляд . // Сайт Biomolecula.ru (8 марта 2015). Дата обращения 31 марта 2018.
- Нестеренко, Ольга. Могут ли условия жизни птиц влиять на пол потомства? . // Biomolecula.ru website (November 16, 2016). Date of appeal March 31, 2018.
- Kondratenko, Julia. If birds experience a shortage of nesting places, their chicks are more aggressive . // Biomolecula.ru website (March 10, 2015). Date of appeal March 31, 2018.
- Agapov, Alexey; Flamer, Ilya. The sex life of chromatin . // Biomolecula.ru website (April 3, 2017). Date of appeal March 31, 2018.