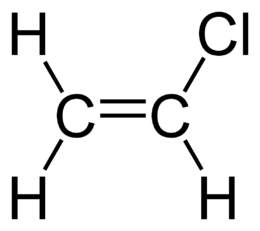
Vinyl chloride ( vinyl chloride , chlorovinyl , chloroethylene , chloroethene , ethylene chloride ) - an organic substance ; a colorless gas with a faint sweet odor, having the formula C 2 H 3 Cl and representing the simplest chlorine derivative of acetylene . The substance is extremely flammable and explosive, emitting toxic substances during combustion. Vinyl chloride is a strong poison that has a carcinogenic , mutagenic and teratogenic effect on humans.
| Vinyl chloride | |
|---|---|
 | |
 | |
| Are common | |
| Systematic name | chlorethylene |
| Traditional names | vinyl chloride, vinyl chloride |
| Chem. formula | CH 2 = CHCl |
| Rac formula | C 2 H 3 Cl |
| Physical properties | |
| condition | colorless gas |
| Molar mass | 62.498 g / mol |
| Density | 0.9106 (at 20 ° C) [1] ; 0.9730 (at −15 ° C) [2] |
| Ionization energy | |
| Thermal properties | |
| T. melt. | −153.8 ° C [2] |
| T. Kip. | −13.8 [2] ° C |
| Etc. blast | |
| Cr. point | 158.4 ° C; 5.34 MPa [3] |
| Like heat resistant. | 0.858 (25 ° C) [3] J / (mol · K) |
| Enthalpy of Education | −37.26 [3] kJ / mol |
| Steam pressure | 337 kPa (20 ° C) [3] |
| Optical properties | |
| Refractive index | 1.3700 (at 20 ° C) [1] |
| Structure | |
| Dipole moment | 1.44 [4] |
| Classification | |
| Reg. CAS number | 75-01-4 |
| Pubchem | |
| Reg. EINECS number | 200-831-0 |
| SMILES | |
| Inchi | |
| RTECS | KU9625000 |
| Chebi | |
| Chemspider | |
The industrial production of vinyl chloride is in the top ten production of the largest large-tonnage products of basic organic synthesis ; while almost the entire volume produced is used for the further synthesis of polyvinyl chloride (PVC), the monomer of which is vinyl chloride.
According to The 100 Most Important Chemical Compounds (Greenwood Press, 2007) [6] , vinyl chloride is one of the hundred most important chemical compounds .
Opening History
Vinyl chloride was first obtained by the professor of chemistry at the University of Giessen, Justus Liebig, in the 1830s by the action of potassium hydroxide alcohol solution on dichloroethane [7] :
Liebig's student, French chemist Henri Victor Renaud , in 1835 confirmed the discovery of Liebig by first publishing an article about this in the publication Annales de chimie et de physique [7] . He first discovered that under the influence of light, a substance turns into a white powder. However, the priority of the invention of polyvinyl chloride is recognized by the German chemist Eugen Baumann , who in 1872 discovered and described the photopolymerization of vinyl chloride [8] .
The first mention of the compound “vinyl chloride” was made by the German chemist Kolbe in 1854 [9] .
In 1912, the German chemist Fritz Klatte ( German Fritz Klatte ) received vinyl chloride by the reaction of acetylene with hydrogen chloride [10] :
The company Greisheim Electron , where the scientist worked, patented in Germany this method and the material obtained by polymerization, but could not find practical application for it. Only in 1933, after research by the American scientist Waldo Simon ( English Waldo Semon ) ( 1926 ), BF Goodrich obtained a patent [11] and developed the first industrial production of vinyl chloride [7] . By 1939, commercial production of vinyl chloride began with the goal of producing PVC for military purposes [9] .
Until the mid-19th century, scientists mistakenly believed that the structure of vinyl chloride is described by the formula C 4 H 3 Cl (the formula C 4 H 4 was attributed to ethylene ) [12] . Only after the work of Emil Erlenmeyer ( 1862 ), who suggested the presence of a double bond in ethylene, did scientists come to a modern understanding of the structure of vinyl chloride.
Of the Russian scientists, Ivan Ostromyslensky (early XX century) was involved in the study of the polymerization of vinyl chloride and the possibilities for its commercial use [13] .
Molecule Structure
In the vinyl chloride molecule, the C – Cl bond is shorter and stronger than the analogous bond in the chloroethane molecule, which is associated with the p , π conjugation of the π orbitals of the multiple bond with the unshared electron pair of the chlorine atom [14] .
The table shows the comparative values of the bond lengths and energies (C – Hal) [15] , as well as the dipole moments in the molecule of vinyl chloride and some chloroalkanes :
| Compound | Bond energy C − Cl, kJ / mol [16] | C – Cl bond length, nm [14] | Dipole moment [molecules], 10 −30 C · m [4] |
|---|---|---|---|
| CH 2 = CHCl | 374.89 | 0.169 | 4.80 |
| CH 3 −CH 2 Cl | 336.39 | 0.179 | 6.66 |
| CH 3 Cl | 349.78 | 0.176 | 6.19 |
The electron density shift in the vinyl chloride molecule from the chlorine atom to the double bond side, due to the conjugation effect (+ M- effect), acts simultaneously with the strong electron - withdrawing inductive effect of the chlorine atom (- I- effect), but the influence of the latter is stronger (- I > + M ), therefore, the halogen bears a small negative charge (see figure) [17] .
Physical Properties
Vinyl chloride under normal conditions is a colorless gas with a faint sweetish odor, reminiscent of the smell of chloroform [2] . The odor threshold in the air is approximately 3000 ppm [18] . Slightly soluble in water (about 0.95 wt.% At 15–85 ° C [19] ), readily soluble in alcohol , chloroform and dichloroethane , soluble in diethyl ether [1] .
Some physical constants of vinyl chloride [3] :
- boiling point : −13.8 ° C;
- melting point : −153.8 ° C [K 1] ;
- relative density at −20 ° C [K 2] : 0.983;
- relative density at 20 ° C: 0.911 (liquid);
- air density : 2.17;
- refractive index at 10 ° C: 1.4046;
- critical temperature : 158.4 ° C;
- critical pressure : 5.34 MPa;
- critical density : 0.370 g / cm³;
- fluid viscosity at −40 ° C: 0.334 MPa · s;
- gas viscosity at 20 ° C: 10.71 μPa · s;
- surface tension at −20 ° C: 22.3 mN / m;
- heat capacity of the liquid at −20 ° C: 1.146 kJ / (kg · K);
- gas heat capacity at 25 ° C: 0.858 kJ / (kg · K);
- thermal conductivity of the liquid at 20 ° C: 0.138 W / (m · K);
- standard enthalpy of formation , Δ H ° 298 : −37.26 kJ / mol;
- standard entropy of formation , S ° 298 : 263.98 J / (mol · K);
- heat of evaporation at boiling point, Δ H isp. : 332.7 kJ / kg;
- calorific value , Δ H ° combustion. : −1198.1 kJ / mol.
According to studies by American scientists [20] , the density of vinyl chloride in the temperature range from the boiling point to 60 ° C with an accuracy of 0.1% is expressed by the following equation
where d is the density, g / cm³; t is the temperature, ° C.
They also obtained a relationship connecting the vapor pressure of vinyl chloride with temperature:
where p is the pressure, atm; T is the temperature, K.
Chemical Properties
Vinyl chloride is an active chemical compound whose chemical properties are determined both by the presence of a double bond and a chlorine atom.
Like alkenes , vinyl chloride undergoes multiple-coupling reactions , while the chlorine atom acts as an electron-withdrawing substituent, thereby reducing the reactivity of the compound in electrophilic addition reactions and increasing the reactivity of the compound in nucleophilic addition reactions .
The chlorine atom in vinyl chloride is very inert, which is associated with the influence of a double bond, therefore, the substitution reactions associated with it are not typical for vinyl chloride. At the same time, it is this property that makes it possible to relatively easily detach a hydrogen chloride molecule from it.
Of greatest interest is the polymerization of vinyl chloride, which is of great practical importance.
Double bond addition reactions
Vinyl chloride easily reacts with chlorine in both the liquid and gas phases to form 1,1,2-trichloroethane :
In this case, the reaction can have both an ionic ( FeCl 3 catalyst ) and a radical character (in the presence of free radical initiators, for example, organic peroxides ) [21] . Chlorine addition can also be accomplished by photochemical initiation [22] or by heating the reaction mixture over 250 ° C in the presence of small amounts of oxygen [23] .
Vinyl chloride binds hydrogen halides via a double bond in accordance with the Markovnikov rule only in the presence of catalysts ( iron (III) chloride, zinc chloride , etc.) at elevated temperatures, forming 1,1-dihaloalkanes [24] :
Hydrogen fluoride reacts with vinyl chloride in the gas phase only at elevated pressure (1-1.5 MPa) [25] :
Hydrogen fluoride reacts with vinyl chloride in the liquid phase in the presence of a tin (IV) chloride catalyst with the substitution of a chlorine atom for fluorine to produce 1,1 - difluoroethane ( freon R152a) - an ozone-friendly refrigerant [26] [27] :
In the presence of peroxides, the addition proceeds differently (only for HCl and HBr ) [28] :
Hydrogen iodide is attached to vinyl chloride in the presence of a catalytic amount of iodine with the formation of 1-chloro-1-iodoethane [29] :
Vinyl chloride reacts with an aqueous solution of chlorine to produce chloroacetaldehyde :
If the reaction is carried out in a methanol solution, chloroacetal is formed [30] :
Under the action of ultraviolet radiation, vinyl chloride reacts with hydrogen sulfide (the catalyst is dialkyldithioesters), forming a poisonous substance mustard [31] :
In the presence of some metal halides ( FeCl 3 , AlCl 3 , etc.), vinyl chloride condenses with chloroethane to form 1,1,3-trichlorobutane; with 2-chloropropane - 1,1-dichloro-3-methylbutane [32] :
With carbon tetrachloride in the presence of CuCl / C 4 H 9 NH 2 or RuCl 2 (PPh 3 ) 3 , 1,1,1,3,3-pentachloropropane forms as a catalyst in high yield [33] :
In the Prince reaction involving vinyl chloride, 3,3-dichloropropanol-1 and 2,3-dichloropropanol are formed [23] :
It reacts with Friedel-Crafts with benzene in the presence of aluminum chloride, forming 1,1-diphenylethane [34] :
Vinyl chloride enters the photochemical reaction of [2 + 2] cycloaddition to 1-isoquinolone [35] :
Chlorine Substitution Reactions
Conventional substitution reactions typical of many halogenated hydrocarbons are not available for vinyl chloride. Usually, under the action of bases , especially when heated, instead of substitution, polymerization or elimination reactions occur [14] .
Nevertheless, in the presence of palladium salts it is possible to carry out nucleophilic substitution at the chlorine atom: in this way it is possible to obtain vinyl alcoholates, as well as simple and complex vinyl esters [23] [36] :
The substitution reaction with sodium alcoholate can be carried out without a catalyst under rather harsh conditions: with prolonged heating in a closed autoclave at a temperature of about 100 ° C [37] :
The amination reaction can also be carried out in the presence of a palladium catalyst [38] :
The reaction with ammonia in the gas phase at 50 ° C in the presence of sodium amalgam leads to aziridine [39] :
Under normal conditions, vinyl chloride does not form Grignard reagents , but vinyl tetrahydrofuran was able to produce vinyl magnesium halides ( Norman reagents ) [40] [41] :
In the future, vinyl magnesium chloride can be used to synthesize a wide range of vinyl derivatives, for example:
By analogy with magnesium , other organometallic compounds can also be obtained, for example, vinyl potassium [42] :
The interaction of vinyl chloride with metallic finely divided lithium in the presence of sodium (2%) in tetrahydrofuran medium leads to vinyl lithium [43] :
By the interaction of vinyl chloride with 2-thienyl magnesium bromide in the presence of cobalt chloride, 2-vinylthiophene can be obtained [44] :
Vinyl chloride reacts with dimethylamine and CO in the presence of a palladium catalyst to form N, N-dimethylacrylamide [45] :
Polymerization Reaction
In the absence of oxygen and light under ordinary conditions, pure vinyl chloride can exist for a long time without undergoing any changes; however, the appearance of free radicals , caused both photochemically and thermochemically, leads to its rapid polymerization.
The polymerization mechanism is radical in nature and can be schematically represented as follows [46] :
The first stage: the action of the initiator [K 3] - the formation of free radicals and the nucleation of the chain.
The second stage: the development of polymerization - the formation of polymer chains.
В процессе образования полимера возможно разветвление цепи [К 4] , а также образование ненасыщенных фрагментов:
Третий этап: завершение полимеризации.
- {\ displaystyle {\ mathsf {- (\! - CH_ {2} \! \! - \! \! CHCl \! -) _ {n} \! \! - \! \! CH_ {2} \! \ ! - \! \! CHCl \! \!! Cdot + RO \ cdot \ rightarrow - (\! - CH_ {2} \! \! - \! \! CHCl \! -) _ {n} \! \! - \! \! CH_ {2} \! \! - \! \! CHCl \! \! - \! \! OR}}}
Other reactions
An almost quantitative yield can be obtained from vinyl chloride butadiene in dimethylformamide- water in the presence of a complex mixed catalyst [47] :
Vinyl chloride in reactions with carboxylic acid chlorides in the presence of aluminum chloride forms dichloroketones and chlorovinyl ketones [48] :
In the presence of palladium ( PdCl 2 ), rhodium ( RhCl 3 • 3H 2 O ) or ruthenium ( RuCl 3 • 3H 2 O ) chlorides, vinyl chloride reacts with alcohols to form acetals [49] :
Oxidation of vinyl chloride with inorganic oxidizing agents, depending on the reaction conditions and the choice of oxidizing agent, leads to the formation of chloroacetaldehyde or formaldehyde , deeper oxidation to carbon monoxide or carbon dioxide , hydrogen chloride and water:
Ozonolysis of vinyl chloride in methanol at a temperature of −78 ° C in high yield leads to methoxymethyl hydroperoxide (1) , which can be further converted into formic acid methyl ester (2) and dimethoxymethane (methylal) (3) [50] :
Vinyl chloride recovery is possible in three different directions, depending on the choice of agent and reaction conditions [51] :
- to ethylene :
- to ethyl chloride :
- to ethane :
Under the action of strong bases, vinyl chloride is able to split off hydrogen chloride , forming acetylene :
Vinyl chloride is a thermally stable compound, a noticeable decomposition of which occurs when heated above 550 ° C. Pyrolysis of vinyl chloride at 680 ° C in 35% yield leads to a mixture of products containing acetylene , hydrogen chloride , chloroprene and vinylacetylene [7] .
Laboratory methods for obtaining
In laboratory conditions, vinyl chloride is obtained by dehydrochlorination of 1,2-dichloroethane or 1,1-dichloroethane with an alcoholic solution of sodium or potassium hydroxide under heating [52] :
Another method - passing acetylene through a concentrated solution of hydrochloric acid in the presence of mercury chloride - is rarely used in laboratory practice:
Another alternative option is catalytic dehydration of ethylene chlorohydrin [17] :
Finally, vinyl chloride can be obtained by the interaction of acetaldehyde with phosphorus pentachloride [53] :
Industrial Production: Technological Aspects
For 2010, there are three main methods for producing vinyl chloride, implemented on an industrial scale [54] :
- catalytic gas-phase hydrochlorination of acetylene ;
- combined method based on ethylene and acetylene ;
- ethylene based chlorine balanced method .
The latter method is the most modern, widespread, and most economically most efficient production technology; however, the first two methods, although obsolete, still exist in many enterprises that are oriented (for various reasons) to the use of expensive acetylene [54] .
There is also a relatively new method, which has not yet become widespread and implemented as a pilot project in 1998 at one enterprise in Germany - oxidative chlorination of ethane .
Catalytic Gas-Phase Acetylene Hydrochlorination
The method of catalytic hydrochlorination of acetylene, in which acetylene was obtained by reacting calcium carbide with water, was the first commercial process for the production of vinyl chloride.
The chemistry of the process is as follows:
- Getting acetylene :
- Acetylene hydrochlorination:
Brief description of production technology [55] :
The produced, purified and dried acetylene (moisture content not exceeding 1.5 g / m³) is mixed with purified and dried hydrogen chloride in a ratio of about 1.0: 1.1. This mixture of gases is fed into the upper part of the tubular reactor , the tubes of which are filled with a catalyst, which is activated carbon impregnated with mercuric chloride HgCl 2 (10-15%). The reactor is made of carbon steel; the height of the pipes is 3–6 meters, and the diameter is 50–80 m. The temperature in the reaction region is 150–180 ° C. After the reactor, the reaction gases are fed into a special column irrigated with hydrochloric acid to extract mercuric chloride. After the first absorption column, reaction gases are supplied to the next, where they are irrigated with water and an alkaline solution to separate hydrogen chloride, acetaldehyde and carbon dioxide. After that, the gases are cooled in a condenser to remove water and fed to the distillation to remove high boiling impurities. The resulting vinyl chloride in the last stage is passed through a column filled with solid sodium hydroxide for complete dehydration and neutralization.
The following is a schematic representation of a process:
As of 1967 , the proportion of the method of catalytic gas-phase hydrochlorination of acetylene in the production capacity for the production of vinyl chloride in the United States was 32.3% (405.6 thousand tons) [56] . In 2001, the American chemical corporation Borden stopped its last acetylene-based facility in Louisiana [57] . In addition to economic considerations, the method of catalytic hydrochlorination of acetylene is environmentally unsafe, since the mercury used in the production, despite recycling, inevitably enters the environment with gaseous waste and wastewater. In 2002, such emissions in Russia amounted to about 31 kg [55] .
The method of catalytic hydrochlorination of acetylene for 2010 is widespread only in China because of its rich coal reserves, the availability of cheap hydroelectric power, and the lack of natural gas , which is the main raw material for the production of ethylene [58] .
From 2003 to 2008, the method again aroused interest due to a significant increase in world oil and gas prices, however, the economic crisis of 2008 again made the direct oxidative chlorination of ethylene the most attractive from an economic point of view [59] .
Ethylene Acetylene Combined Method
The combined method based on ethylene and acetylene consists in combining the reaction of chlorination of ethylene and the subsequent destruction of dichloroethane with the reaction of hydrochlorination of acetylene and the use of hydrogen chloride from the thermal decomposition stage for the latter [60] .
Chemistry of the process [60] :
The method made it possible to replace half of acetylene with cheaper ethylene, as well as to utilize hydrogen chloride, thereby increasing the useful use of chlorine to almost 100% [60] .
Ethylene Chlorine Balanced Method
General description of the method
For 2010, the most modern and most effective from an economic point of view is a balanced process of oxidative chlorination of ethylene. In 2006, more than 95% of vinyl chloride was produced by this method [57] .
In an ethylene-based process, vinyl chloride is obtained by pyrolysis of dichloroethane, which, in turn, is synthesized by the catalytic reaction of chlorine with ethylene . Hydrogen chloride resulting from the dehydrochlorination of dichloroethane reacts with oxygen and ethylene in the presence of a copper catalyst, forming dichloroethane and thereby reducing the consumption of elemental chlorine used for direct chlorination of ethylene. This process is known as oxychlorination. To obtain a marketable product, vinyl chloride is purified by distillation , and organochlorine by-products are either isolated to obtain solvents or subjected to thermal degradation to involve hydrogen chloride again in the process [57] .
The chemistry of the process is as follows [23] [54] :
- Ethylene Chlorination:
- stage mechanism:
- Thermal dehydrochlorination of dichloroethane :
- stage mechanism:
- Oxidative chlorination of ethylene:
- stage mechanism:
With this production scheme, the distribution of ethylene occurs approximately equally between the stages of direct and oxidative chlorination.
Vinnolit VCM Process
One of the most common vinyl chloride production technologies in the world is the Vinnolit VCM Process , licensed by the German company Vinnolit GmbH & Co. : since 1964, approximately 5.5 million tons of vinyl chloride production capacities have been installed worldwide in this process [61] .
The following is a schematic representation of a process:
Brief description of the process steps:
- Direct chlorination of ethylene [62] :
- The ethylene chlorination reaction proceeds in the liquid phase in dichloroethane at a temperature of 50–125 ° С in the presence of a special improved (as compared to FeCl 3 ) complex catalyst that prevents the formation of by-products, which is not consumed in the synthesis process and remains in the reactor volume. Due to this, the resulting dichloroethane does not require purification (purity reaches 99.9% or more) and directly enters the pyrolysis stage.
- Ethylene oxychlorination process [63] :
- The oxychlorination process is an exothermic reaction , accompanied by the release of a large amount of heat (ΔH = −238 kJ / mol) and passing in the presence of oxygen (mainly) or air. The reaction gas mixture is heated to temperatures above 210 ° C, and the generated heat of reaction is used to generate steam. The degree of conversion of ethylene reaches 99%, and the purity of the resulting dichloroethane - 99.5%.
- Dichloroethane distillation process [64] :
- Distillation is required for the dichloroethane formed during the oxychlorination process, as well as the unreacted (return) dichloroethane from the pyrolysis step. Water and low boiling components are removed in a drying column. VAT residue in the future goes to the stage of regeneration.
- Dichloroethane pyrolysis [65] :
- Dichloroethane pyrolysis is carried out in special furnaces (operating period - up to 2 years) at a temperature of 480 ° C; while the heat of the process is used for evaporation and heating.
- Vinyl chloride distillation [66] :
- Pyrolysis products, consisting mainly of dichloroethane, vinyl chloride and hydrogen chloride, are sent to the distillation unit. Hydrogen chloride is returned to the oxychlorination unit, vinyl chloride is removed through the top of the column, and the bottom residue, consisting of unreacted dichloroethane, is returned to the distillation process after removal of by-products.
- By-product recovery [67] :
- Liquid and gaseous by-products are completely burned at a temperature of 1100–1200 ° С, forming hydrogen chloride, which after purification returns to the oxychlorination process; incidentally, due to the high temperature, medium pressure steam is also produced.
The estimated material and energy balance of the process (per 1000 kg of vinyl chloride) [61] :
- Ethylene: 460 kg;
- Chlorine: 585 kg;
- Oxygen: 139 kg;
- Steam: 125 kg;
- Electricity: 120 kWh;
- Water: 150 m³.
Ethane Oxidative Chlorination Method
The idea to use ethane for the synthesis of vinyl chloride was realized in 1965-1967 at the pilot production of The Lummus Co. and Armstrong Cork Co. The technology of direct oxychlorination in the presence of copper (I) chloride was called Transcat Process [68] .
Chemistry of the process [68] :
The process took place at 450-550 ° C and a pressure of 1 MPa; the degree of ethane conversion reached 65–70% [68] . The method was subsequently optimized by ICI , which reduced the temperature range of the synthesis and proposed another catalyst [68] .
In May 1998, EVC International NV ( Netherlands ) launched a pilot project with a capacity of 1000 tons per year at a plant in Wilhelmshaven ( Germany ) to test and subsequently market the patented process of oxidative chlorination of ethane, or Ethane-to-VCM-Process . It was supposed that this project would be a technological breakthrough and would be the beginning of work on a full-scale plant, which was expected to be launched in 2003 [69] .
According to the manufacturer, the process temperature is less than 500 ° C, the degree of conversion of raw materials is 100% for chlorine, 99% for oxygen and more than 90% for ethane; the yield of vinyl chloride exceeds 90% [69] .
In September 1999, EVC signed with Bechtel Group, Inc. ( USA ) agreement to build a full-fledged production in Wilhelmshaven, but due to financial problems the project was not implemented [70] .
Following the takeover of EVC's INEOS Corporation in 2001 [71] , the further fate of the Ethane-to-VCM-Process project is not known [72] .
Alternative Vinyl Chloride Production Methods
In 1977, Monsanto proposed a one-stage method for producing vinyl chloride with up to 85% yield of ethane under the action of a mixture of hydrogen chloride and oxygen at a temperature of 400-650 ° С in the presence of a catalyst (copper halide and potassium phosphate) [73] :
In 1980, Soviet scientists patented an alternative method for producing vinyl chloride by gas-phase chlorination of a mixture containing ethane and ethylene at a temperature of 350-500 ° С, which corresponds to the following chemical model:
By-products of the reaction are chloroethane , 1,1-dichloroethane , vinylidene chloride and other halogen derivatives.
One of the most recently developed production methods (2005) is a method for producing vinyl chloride by the interaction of methyl chloride and methylene chloride in the gas phase at a temperature of 300-500 ° C, pressure from 0.1 to 1 MPa, in the presence of catalysts (active aluminum oxide or phosphate, aluminosilicates , zinc chloride with alumina) [74] :
All of the above methods for producing vinyl chloride [K 5] either were not implemented in industry, or did not leave the stage of experimental production.
Industrial Production: Economic Aspects
Worldwide vinyl chloride production
Vinyl chloride is in the TOP 20 of the world's largest petrochemical products by volume [75] , second only to ethylene (123 million tons in 2010 [76] ), propylene (77 million tons in 2010 [77] ), methanol (48–49 million tons in 2010 [78] ), terephthalic acid (42 million tons in 2008 [79] ), benzene (40 million tons in 2010 [80] ). Производство винилхлорида является третьим после полиэтилена и окиси этилена по значимости направлением использования этилена как важнейшего химического сырья и составляет 11,9 % его мирового потребления (по данным на 2008 год) [81] . Мировое производство винилхлорида в 2010 году составило около 35 млн тонн [82] (36,7 млн тонн в 2008 году [83] ), что составляет 70 % всех мировых производственных мощностей (в 2007 году — 90 %, 2008 году — 85 %). По прогнозным данным компании IHS , текущее потребление винилхлорида в период с 2010 по 2015 гг. будет расти в размере 4,4 % в год и 4,2 % в последующие пять лет (с 2015 по 2020 г.) [82] .
По состоянию на 1997 и конец 2004 года мировые мощности по производству винилхлорида по регионам выглядят следующим образом:
| Region | Мощность на 1997 год, тыс. тонн [23] | Мощность на 2004 год, тыс. тонн [7] |
|---|---|---|
| North America USA Canada Mexico | 7385 6741 374 270 | 8988 8018 500 470 |
| South America Brazil Argentina Venezuela | 880 540 160 180 | 1035 655 230 150 |
| Western Europe Belgium France Germany Italy Netherlands Norway Spain Sweden Great Britain | 6409 1010 1205 1710 620 520 470 399 115 360 | 6495 880 1205 2015 440 600 470 465 120 300 |
| Восточная и Центральная Европа Россия и страны СНГ Чехия и Словакия Югославия (бывшая) Hungary Poland Romania | 2342 1085 217 260 185 325 270 | 2011 884 217 160 255 300 200 |
| Africa Algeria Egypt Libya Morocco South Africa | 405 40 100 62 38 165 | 408 40 100 62 38 168 |
| Ближний Восток Iran Israel Qatar Saudi Arabia Turkey | 862 213 110 - 360 179 | 1092 240 - 300 400 152 |
| Азия [К 6] China India Indonesia Japan North Korea South Korea Pakistan Philippines Taiwan Thailand | 7145 1356 610 150 2965 24 755 five ten 1030 240 | 13082 4436 845 500 3260 24 1520 - - 1870 627 |
| Australia and Oceania Australia | 36 36 | - - |
| TOTAL | 25 464 | 33 111 |
Крупнейшим потребителем винилхлорида в мире является Китай: около 30 % всего мирового производства; на втором месте США и Канада, приблизительно с 20 % (по состоянию на 2008 год ) [59] . Крупнейшим производителем винилхлорида в мире (по объёму производственных мощностей) являются США : 8,24 млн тонн по данным на 2003 год [84] (для сравнения — в 1967 году мощности составляли 1,26 млн тонн, а в 1960 году всего 0,67 млн тонн [56] ).
Крупнейшие производители США и Канады по объёму производственных мощностей по данным на 2003 год [84] :
- Dow Chemical — 2,4 млн тонн ( 2006 год ) [85] ;
- Occidental Chemical Corporation — 1,68 млн тонн;
- Georgia Gulf — 1,18 млн тонн;
- Oxymar — 1,04 млн тонн;
- Formosa Plastics — 1,00 млн тонн.
В 1997 году крупнейшими мировыми компаниями-производителями (42 % всего суммарного объёма мировых производственных мощностей) были [86] :
- Dow Chemical — 1906 тыс. тонн;
- Formosa Plastics — 1643 тыс. тонн;
- EVC — 1370 тыс. тонн;
- Solvay — 1193 тыс. тонн;
- The Geon Company — 1088 тыс. тонн;
- Occidental Chemical — 1020 тыс. тонн;
- Elf-Atochem — 803 тыс. тонн;
- Georgia Gulf — 726 тыс. тонн;
- Norsk Hydro — 595 тыс. тонн;
- Tosoli Corporation — 570 тыс. тонн.
По состоянию на 2005 год крупнейшими мировыми компаниями-производителями являются (перечислены в порядке убывания) [87] :
- Formosa Plastics ;
- Dow Chemical ;
- Occidental Chemical Corporation ;
- Solvay ;
- Georgia Gulf ;
- INEOS ;
- Tosoh ;
- Total Petrochemicals ;
- LG Chemicals ;
- Shin-Etsu Chemical .
Производство винилхлорида в России
Вклад России в мировое производство винилхлорида довольно скромный: около 1,5 % от годового глобального выпуска и место во второй двадцатке стран-производителей (по состоянию на 2008 год). При этом технологическое оснащение серьёзно отстаёт от мирового: почти 30 % мощностей используют устаревшую ацетиленовую технологию.
Производство винилхлорида в России практически полностью (более 99 % всего объёма) ориентировано на выпуск поливинилхлорида, являясь при этом одним из крупнейших направлений потребления хлора в российской химической промышленности (18 % по данным на 2004 год) [88] .
По состоянию на 2009 год производство винилхлорида в России осуществляется на следующих предприятиях:
| Name | Region | Технология производства [К 7] | Производственная мощность, тыс. тонн/год | Произведено в 2008 году, тыс. тонн |
|---|---|---|---|---|
| ОАО «Саянскхимпласт» | г. Саянск , Иркутская область | СХМЭ | 270,0 [89] | 250,0 [К 8] [90] |
| ОАО «Каустик» | г. Стерлитамак , Республика Башкортостан | СХМЭ | 165,0 [91] | 165,0 [К 8] [91] |
| ОАО «Пласткард» | г. Волгоград | КМЭА | 100,0 [К 9] | 96,3 [92] |
| ОАО «Сибур-Нефтехим» (завод «Капролактам») | г. Дзержинск , Нижегородская область | СХМЭ | 90,0 [93] | 78,5 [93] |
| ОАО «НАК Азот» | г. Новомосковск , Тульская область | КГА | 45,0 [55] | нет данных [К 10] |
| ВОАО «Химпром» | г. Волгоград | КГА | 27,0 [55] | 21,7 [К 8] [94] |
| ООО «Усольехимпром» | г. Усолье-Сибирское , Иркутская область | КГА | 26,0 [55] | < 20,0 |
| Total | 723,0 | 620,0—650,0 | ||
Во сентябре 2014 года компанией ООО «РусВинил» было осуществлено торжественное открытие нового комплекса по производству ПВХ (включая и производство винилхлорида) в Кстовском районе Нижегородской области мощностью 330 тыс. тонн в год [95] . Учредителями совместного предприятия стали компания «Сибур» и бельгийская компания SolVin — совместная дочерняя компания международной химико-фармацевтической группы Solvay и немецкого концерна BASF [96] .
Производство винилхлорида на Украине
По состоянию на 2018 год, единственным действующим производителем винилхлорида на Украине является ООО «Карпатнефтехим» ( г. Калуш ), входящий до февраля 2017 года в состав российской группы Лукойл [К 11] . Производство осуществляется прямым хлорированием этилена; мощность производства — 370 тыс. тонн в год [97] .
Application
Производство поливинилхлорида
В настоящее время 98—99 % всего производимого в мире винилхлорида используется для дальнейшего производства ПВХ [82] [98] . В 2009 году совокупные глобальные мощности по выпуску поливинилхлорида составляли около 48 млн тонн, а его мировое производство и потребление − 29,92 млн тонн, что соответствует уровню загрузки 62 % [99] .
Более половины мирового производства ПВХ (57 % по состоянию на 2009 год ) сосредоточено в Азии, причём 20 % в Китае [99] . Крупнейшими мировыми производителями поливинилхлорида в 2001 году были компании Shin-Etsu ( Япония ) — 2,75 млн тонн, Formosa Plastics ( Тайвань ) — 2,63 млн тонн и OxyVinyls ( США ) — 2,01 млн тонн [100] . В 2011 году производственные мощности крупнейших мировых производителей ПВХ составляли [101] :
- Shin-Etsu ( Япония ) — 3,69 млн тонн;
- Formosa Plastics ( Тайвань ) — 3,30 млн тонн;
- Solvay ( Бельгия ) — 2,60 млн тонн;
- LG Chem ( Южная Корея ) — 2,31 млн тонн;
- Kerling ( Великобритания ) — 1,99 млн тонн.
Объём производства ПВХ в России в 2008 году составил 578,3 тыс. тонн (−1,4 % по отношению к 2007 году ), суммарная мощность производства ПВХ составляет 635,8 тыс. тонн [91] .
В настоящий момент существуют четыре принципиально различных технологии полимеризации винилхлорида (перечислены в порядке убывания распространения) [46] :
- суспензионная полимеризация : полимеризация винихлорида в каплях эмульсии , полученной диспергированием мономера в воде, в присутствии стабилизатора эмульсии и мономер-растворимого инициатора полимеризации;
- Типичный массовый состав для суспензионной полимеризации:
- винилхлорид — 33,3 %;
- вода — 66,6 %;
- инициатор (например, органический пероксид) — 0,015 %;
- стабилизатор (например, поливиниловый спирт) — 0,005 %.
- дисперсионная полимеризация : полимеризация винилхлорида в воде в присутствии ПАВ и водорастворимых инициаторов ( персульфат калия , персульфат аммония , перкарбонат натрия , пероксиуксусная кислота , пероксид водорода и гидропероксид кумола и пр.) с образованием стабильных дисперсий из очень маленьких частиц;
- полимеризация в массе : третий по важности метод, заключающийся в полимеризации винилхлорида в объёме целиком, без добавок воды, ПАВ, растворителей или иных вспомогательных компонентов (за исключением мономер-растворимых инициаторов, таких, как ди-(2-этилгексанол)пероксид, 3,5,5-триметилгексанолпероксид, ди-(трет-бутил)пероксиоксалат, ди-2-бутоксиэтилпероксидикарбонат, ди-4-хлорбутилпероксидикарбонат, азобис(изобутиронитрил), азобис-(циклогексилкарбонитрил));
- полимеризация в растворе : наиболее редкий и специфический метод, применяемый для получения сополимеров , используемых в создании полимерных покрытий.
В мире наиболее распространён метод суспензионной полимеризации (80 % всего объёма производства [46] ), причём наиболее современными и популярными являются следующие технологии [102] :
- Chisso PVC Process ;
- Vinnolit Suspension PVC Process .
Chisso PVC Process
Корпорация Chisso — лидер японской полимерной промышленности — разработала современную технологию суспензионного производства поливинилхлорида: Chisso PVC Process . Особенности метода — получение высококачественного продукта с использованием безопасной и безвредной для окружающей среды технологии, низкие начальные инвестиции и низкие операционные издержки.
Chisso PVC Process лицензирован на 19 предприятиях по всему миру, суммарная мощность — свыше 1,5 млн тонн в год [103] .
Vinnolit Suspension PVC Process
Метод суспензионной полимеризации винилхлорида был изобретён и запатентован в 1935 году компанией Wacker Chemie GmbH , одним из прежних учредителей компании Vinnolit . После многократных усовершенствований Vinnolit Suspension PVC Process стал одним из современных и очень экономически эффективных процессов для производства поливинилхлорида во всём мире [104] .
Реакция полимеризации осуществляется периодическим способом в реакторах объёмом около 170 м³, при этом особенность конструкции позволяет эффективно удалять тепло из реакционной смеси без использования обратного холодильника или воды для охлаждения, тем самым обеспечивая высокую производительность. Кроме того, особенности технологии позволяют получить готовый продукт с минимальным содержанием непрореагировавшего винилхлорида без применения температурной дегазации, сохраняя тем самым структуру полимера [104] .
Прочие направления использования
Около 1 % винилхлорида используется для получения сополимеров с винилацетатом и другими мономерами [57] .
Не более 1 % винилхлорида применяют для органического синтеза следующих соединений [105] :
- 1,1,1-трихлорэтан :
- Винилиденхлорид :
- Хлорацетальдегид :
До середины 1970-х годов винилхлорид использовался как хладагент, пропеллант для аэрозольных баллонов и компонент для некоторых видов косметики [106] .
Огне- и пожароопасность
Вещество является чрезвычайно огнеопасным, его смеси с воздухом взрывоопасны; при горении выделяет раздражающие, токсичные и коррозионно-активные вещества [К 12] [107] , среди которых, в частности, обнаруживается крайне ядовитый фосген [108] .
Температура вспышки : −78 °C [109] ; температура самовоспламенения : 472 °С [7] . Пределы воспламенения в воздухе: 3,6—33 % [110] .
Гашение пламени при горении винилхлорида производят только после остановки подачи газа, при этом используют воду на максимально возможном от очага возгорания расстоянии, создавая плотную туманоподобную завесу, а также охлаждая горячие поверхности [108] .
Рейтинг NFPA 704 [111] : [К 13]
Физиологическое действие
Винилхлорид очень токсичен. Оказывает комплексное токсическое воздействие на организм человека, вызывая поражение ЦНС , костной системы, системное поражение соединительной ткани, мозга, сердца. Поражает печень, вызывая ангиосаркому. Вызывает иммунные изменения и опухоли, оказывает канцерогенное , мутагенное и тератогенное действие [112] .
Многие исследования сообщают, что воздействие винилхлорида на человека вызывает образование злокачественных новообразований в различных тканях и органах, включая печень (опухоли, помимо ангиосаркомы), мозг, лёгкие, лимфатическую и гематопоэтическую систему (органы и ткани, вовлечённые в кровообразование) [113] . При этом можно отметить, что употребление этанола только усиливает канцерогенный эффект винилхлорида [114] .
Хроническая интоксикация винилхлоридом носит название «винилхлоридной болезни» [115] .
Физиологическое воздействие винилхлорида на людей имеет преимущественно ингаляционный характер, причём его опасная концентрация в воздухе (1 часть на миллион [К 14] ) ниже предела его обнаружения человеком посредством обоняния (3000 частей на миллион) [18] . Концентрация в размере 8000 частей на миллион вызывает головокружение, а при уровне 20000 частей на миллион появляется сонливость, потеря координации, визуальные и слуховые отклонения, дезориентация, тошнота, головная боль, синдром жжения конечностей [18] . Продолжительное воздействие более высоких концентраций винилхлорида может вызвать смерть из-за паралича центральной нервной системы и остановки дыхания [18] . Следует иметь в виду, что газ тяжелее воздуха и может вызвать удушье в плохо проветриваемых или замкнутых помещениях [18] .
В организме человека винилхлорид биотрансформируется преимущественно ферментами печени, при этом основным его метаболитом , выводящимся с мочой, является тиодигликолевая кислота [110] .
Метаболический путь винилхлорида в организме человека представлен на рисунке [116] :
Острый токсический эффект винилхлорида для различных животных [117] :
- Крысы: ЛД 50 ( англ. LD 50 ) ⩾ 400 мг/кг (перорально);
- Крысы: ЛК 50 ( англ. LC 50 ) = 390 000 мг/м³ (ингаляционно);
- Мыши: ЛК 50 ( англ. LC 50 ) = 294 000 мг/м³ (ингаляционно).
Воздействие на окружающую среду
В окружающей среде винилхлорид появляется исключительно вследствие его выбросов во время производства и переработки. По оценке специалистов, более 99 % выброса винилхлорида остаётся в воздухе [117] , где происходит его фотохимическая деградация под воздействием гидроксил-радикалов; при этом период его полураспада составляет 18 часов [118] (по другим данным, это время составляет 2,2—2,7 дней [117] ).
С поверхности почвы винилхлорид быстро испаряется, однако может мигрировать в её глубь через грунтовые воды [118] . В растениях и животных не накапливается [118] .
В почве и воде винилхлорид подвергается аэробной биодеградации (преимущественно до CO 2 ) под воздействием микроорганизмов, например, рода Микобактерии ( Mycobacterium ) [119] ; биораспад в грунтовых водах может носить и анаэробный характер, причём его продуктами являются метан , этилен , углекислый газ и вода [120] .
Исследования показывают, что в почве и воде под действием микроорганизмов винилхлорид разлагается на 30 % в течение 40 дней и на 99 % в течение 108 дней [117] .
Гигиенические нормативы
Основные гигиенические нормативы для винилхлорида:
Россия [121] :
- ПДК максимально разовая в воздухе рабочей зоны: 5 мг/м³;
- ПДК среднесменная в воздухе рабочей зоны = 1 мг/м³;
- класс опасности для рабочей зоны: 1 (чрезвычайно опасное);
- особенность токсического действия на организм: K ( канцероген );
- ПДК среднесуточная в атмосферном воздухе населённых мест = 0,01 мг/м³;
- класс опасности для населённых пунктов: 1 (чрезвычайно опасное);
- лимитирующий показатель воздействия: резорбтивный.
- ПДК в воде = 0,005 мг/м³;
Великобритания :
- предельно допустимая концентрация ( Maximum Exposure Limits, MEL ) [К 15] : 7 ppm [122] ;
США :
- предельно допустимая концентрация в рабочей зоне при длительном воздействии ( Threshold Limit Value — Time Weighted Average, TLV-TWA ) [К 16] : 1 ppm [123] ;
- допустимый предел воздействия ( Permissible Exposure Limit, PEL ):1 ppm [111] ;
- уровень минимального риска ( Minimal Risk Levels, MRL ) [124] :
- острое ингаляционное воздействие: 0,5 ppm;
- разовое пероральное воздействие: 0,03 ppm;
- хроническое пероральное воздействие: 0,003 мг/кг в день.
Обращение, хранение и транспортировка
Винилхлорид хранится вдали от источников тепла и огня в жидком виде при температуре −14…22 °C в больших сферических металлических заземлённых ёмкостях с небольшой добавкой стабилизатора (например, гидрохинон ). Ёмкости должны быть оснащены самозапорными клапанами, устройствами контроля давления и искрогасителями. Контейнер с веществом должен находиться в хорошо проветриваемых условиях при внешней температуре ниже 50 °C. Необходимо избегать контакта с медью , любыми источниками огня или тепла, окислителями , каустической содой и активными металлами. Стабилизированный хлористый винил транспортируется в жидком виде в охлаждаемых стальных цистернах, которые предварительно должны быть тщательно высушены и продуты азотом [123] [125] .
See also
- Ацетилен
- Винил (радикал)
- 1,2-дихлорэтан
- Поливинилхлорид
- Этилен
Notes
- ↑ Значение приведено по Винилхлорид // Большая советская энциклопедия : [в 30 т.] / гл. ed. A. M. Prokhorov . - 3rd ed. - M .: Soviet Encyclopedia, 1969-1978. . По-видимому, данные в «Химической энциклопедии» (−158,4 °C) не вполне корректны. В российской и зарубежной научной литературе приводится значение −153,8 °C или близкое к нему (±0,1 °C).
- ↑ Плотность вещества, отнесённая к плотности воды при температуре 4 °C.
- ↑ В качестве инициатора для примера рассматривается органический пероксид.
- ↑ Представлен один из возможных вариантов.
- ↑ Приведённые в статье альтернативные методы не являются исчерпывающими.
- ↑ По состоянию на 2010 год, одним из крупных производителей винилхлорида является не упомянутая в этой таблице Малайзия . Завод компании Petronas Архивная копия от 9 июня 2010 на Wayback Machine имеет мощность 400 тыс. тонн/год.
- ↑ Сокращения:
- КГА — каталитическое газофазное гидрохлорирование ацетилена;
- КМЭА — комбинированный метод на основе этилена и ацетилена;
- СХМЭ — сбалансированный по хлору метод на основе этилена.
- ↑ 1 2 3 В пересчёте на поливинилхлорид.
- ↑ Ориентировочное значение, рассчитанное исходя из данных по фактическому выпуску винилхлорида и производственной мощности по выпуску ПВХ.
- ↑ На официальном web-сайте компании Архивная копия от 16 сентября 2009 на Wayback Machine упоминание о производстве винилхлорида или ПВХ отсутствует.
- ↑ По данным издательства "Коммерсантъ" по состоянию на 01.01.2018 актив принадлежит украинским предпринимателям: Ильхаму Мамедову через Xedrian Holding Ltd (Кипр) и Techinservice Limited (Великобритания) Игорю Щуцкому.
- ↑ Основными продуктами горения винилхлорида являются углекислый и угарный газ , а также хлороводород .
- ↑ Расшифровка обозначений:
- синий цвет — опасность для здоровья;
- красный цвет — пожароопасность;
- жёлтый цвет — химическая активность.
- ↑ Речь идёт о предельно допустимой концентрации винилхлорида в рабочей зоне при длительном воздействии (TLV-TWA) — нормативе, принятом в США.
- ↑ Определяется исходя из однократного воздействия в течение 8 часов.
- ↑ Определяется исходя из постоянного воздействия в течение 8-часового рабочего дня, 40 часов в неделю.
Использованная литература и источники
- ↑ 1 2 3 Таблица органических соединений . Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений . ChemAnalitica.com (31 марта 2009 года). Дата обращения 27 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 Винилхлорид // Большая советская энциклопедия : [в 30 т.] / гл. ed. A. M. Prokhorov . - 3rd ed. - M .: Soviet Encyclopedia, 1969-1978.
- ↑ 1 2 3 4 5 Ю. А. Трегер. Винилхлорид // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М. : Советская энциклопедия, 1988. — Т. 1. — С. 373—374. — 624 с.
- ↑ 1 2 Дипольные моменты некоторых веществ . Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность . ChemAnalitica.com (1 апреля 2009 года). Дата обращения 21 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0658.html
- ↑ Myers, Rusty L.; Myers, Richard L. The 100 most important chemical compounds: a reference guide. — Westport, Conn : Greenwood Press, 2007. — ISBN 0-313-33758-6 .
- ↑ 1 2 3 4 5 6 Cowfer JA Part 2. Vinyl Chloride Monomer // PVC Handbook / Wilkes CE, Summers JW, Daniels CA. — 1 st ed. — Munich: Carl Hanser Verlag, 2005. — P. 19—56. — ISBN 1-56990-379-4 .
- ↑ History of PVC (англ.) . PVC Awareness Project. Дата обращения 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Lawrie Lloyd. Handbook of Industrial Catalysts. — Springer Science+Business Media, LLC, 2011. — P. 268. — 512 p. — ISBN 978-0-387-24682-6 .
- ↑ Poly(vinyl chloride) (англ.) . Polymer science learning center . The University of Southern Mississippi, The Department of Polymer Science. Дата обращения 27 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Unated States Patens 1929453. Synthetic rubber-like composition and method of making same (англ.) (pdf). FreePatentsOnline (Oct. 10, 1933). Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Berthelot M. Chimie organique fondée sur la synthèse. — Paris: Mallet-Bachelier, 1860. — Т. 1. — P. 219.
- ↑ Synthetic plastics (англ.) (недоступная ссылка) . Timeline . Plastics Historical Society. Дата обращения 27 октября 2009. Архивировано 13 августа 2006 года.
- ↑ 1 2 3 Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т. / В. Ф. Травень. — М. : ИКЦ «Академкнига», 2004. — Т. 1. — С. 583; 640—641. — ISBN 5-94628-171-2 .
- ↑ Длину и энергию кратной связи в винилхлориде см. в Химическая энциклопедия /И. Л. Кнунянц (Гл. ред.).
- ↑ Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону / Отв. ed. В. Н. Кондратьев. — М. : Наука, 1974. — С. 88.
- ↑ 1 2 Нейланд О. Я. Органическая химия: Учеб. для хим. universities. — М. : Высшая школа, 1990. — С. 240. — ISBN 5-06-001471-1 .
- ↑ 1 2 3 4 5 Medical Management Guidelines for Vinyl Chloride (англ.) . Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ DeLassus Ph. T., Schmidt DD Solubilities of vinyl chloride and vinylidene chloride in water (англ.) // Journal of Chemical & Engineering Data. — 1981. — Vol. 26 , no. 3 — P. 274—276 .
- ↑ Dana LI, Burdick JN, Jenkins AC Some Pysical Properties of Vinyl Chloride (англ.) // Journal of the American Chemical Society. — 1927. — Vol. 49 , no. 11 — P. 2801—2806 .
- ↑ Unated States Patens 5315052. Concurrent production of trichloroethane isomers (англ.) (pdf). FreePatentsOnline (May 24, 1994). Дата обращения 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Ayscough PB, Cocker AJ, Dainton FS, Hirst S. Photochlorination studies. Part 8.—Competitive photochlorination in mixtures of cis-1, 2-dichloroethylene with (a) vinyl chloride and (b) trichloroethylene (англ.) // Transactions of the Faraday Society. — 1962. — Vol. 58 . — P. 318—325 .
- ↑ 1 2 3 4 5 Vinyl Chloride // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4th edition. — New York: John Wiley & Sons, 1994. — Т. 24. — P. 413—425.
- ↑ Rinker RG, Corcoran WH Catalytic Addition of Hydrogen Chloride to Vinyl Chloride (англ.) // Industrial & Engineering Chemistry Fundamentals. — 1967. — Vol. 6 , no. 3 — P. 333—338 .
- ↑ Шепард У., Шартс К. Органическая химия фтора = Organic Flourine Chemistry / Пер. с англ., под ред. академика И. Л. Кнунянца. — М. : Мир, 1972. — С. 59.
- ↑ Промышленные фторорганические продукты: справочное издание / Б. Н. Максимов, В. Г. Барабанов, И. Л. Серушкин и др.. — 2-е, перераб. и доп.. — СПб: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X .
- ↑ Н. С. Верещагина, А. Н. Голубев, А. С. Дедов, В. Ю. Захаров. Российский химический журнал. Журнал Российского химического общества им. D.I. Mendeleev. — 2000. — Т. XLIV, выпуск 2. — С. 110-114.
- ↑ Kharasch MS , Hannum CW The Peroxide Effect in the Addition of Reagents to Unsaturated Compounds. IV. The Addition of Halogen Acids to Vinyl Chloride (англ.) // Journal of the American Chemical Society. — 1934. — Vol. 56 , no. 3 — P. 712—714 .
- ↑ Unated States Patens 5345018. Method for preparing 1-chloro-1-iodoethane (англ.) (pdf). FreePatentsOnline (Mar 22, 1993). Дата обращения 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Unated States Patens 4130592. Method for the preparation of chloroacetaldehydedimethyl acetal (англ.) (pdf). FreePatentsOnline (Dec 19, 1978). Дата обращения 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ Франке З. Химия отравляющих веществ / Пер. с нем.. — М. : Химия, 1973. — Т. 1. — С. 147—148.
- ↑ Schmerling L. Condensation of Saturated Halides with Unsaturated Compounds. II. The Condensation of Alkyl Halides with Monohaloölefins 1 (англ.) // Journal of the American Chemical Society. — 1946. — Vol. 68 , no. 8 . — P. 1650—1654 .
- ↑ Kotora M., Hájekand M. Addition of tetrachloromethane to halogenated ethenes catalyzed by transition metal complexes (англ.) // Journal of Molecular Catalysis. — 1992. — Vol. 77 , no. 1 . — P. 51—60 .
- ↑ Davidson JM, Lowy A. Reactions of Vinyl Chloride and Benzene in the Presence of Aluminium Chloride (англ.) // Journal of the American Chemical Society. — 1929. — Vol. 51 , no. 10 . — P. 2978—2982 .
- ↑ Chiba T., Takada Y., Kaneko C., Kiichi F., Tsuda Y. Cycloadditions in Syntheses. LII. Stereochemical Pathways of 1-Isoquinolone-Chloroehylene Photo[2+2 cycloaddition: Determination of Regio- and Stereostructures of the Products and Explanation for Their Formation] (англ.) // Chemical & Pharmaceutical Bulletin. — 1990. — Vol. 38 , no. 12 . — P. 3317—3325 .
- ↑ Henry PM Catalysis by metal complexes // Palladium catalyzed oxidation of hydrocarbons. — Dordrecht: D.Riedel Publishing Company, 1980. — Т. 2. — P. 86. — ISBN 90-277-0986-6 .
- ↑ Schildknecht CE, Zoss AO, McKinley C. Vinyl Alkyl Ethers (англ.) // Industrial & Engineering Chemistry. — 1947. — Vol. 39 , no. 2 — P. 180–186 .
- ↑ Дядченко В. П., Трушков И. В., Брусова Г. П. Часть 3 // Синтетические методы органической химии. — М. : МГУ им. Ломоносова, Химический факультет, 2004. — С. 47.
- ↑ Hatch LF Amination // Encyclopedia of Chemical Processing and Design: Volume 3 — Aluminum to Asphalt: Design / Edited by John J. McKetta, William A. Cunningham. — New York: Marcel Dekker, Inc, 1977. — Т. 3. — P. 140—141. — ISBN 0-824-72453-4 .
- ↑ Вацуро К. В., Мищенко Г. Л. 428. Норман (Normant) // Именные реакции в органичнеской химии. — М. : Химия, 1976. — С. 299.
- ↑ Ramsdem HE, Leebrick JR, Rosenberg SD, Miller EH, Walburn JJ, Balint AE, Cserr R. Preparation of Vinylmagnesium Chloride and Some Homologs (англ.) // The Journal of Organic Chemistry. — 1957. — Vol. 22 , no. 12 . — P. 1602—1605 .
- ↑ Anderson R., Silverman M., Ritter D. Vinyl-Alkali Metal Compounds (англ.) // The Journal of Organic Chemistry. — 1958. — Vol. 23 , no. 5 — P. 750 .
- ↑ West R., Glaze W. Direct Preparation of Vinyllithium (англ.) // The Journal of Organic Chemistry. — 1961. — Vol. 26 , no. 6 . — P. 2096 .
- ↑ Strassburg RW, Gregg RA, Walling Ch. Substituted Styrenes. II. The Preparation of p-Iodo-, p-Nitro- and p-Dimethylaminostyrene and α-Vinylthiophene (англ.) // Journal of the American Chemical Society. — 1947. — Vol. 69 , no. 9 . — P. 2141—2143 .
- ↑ Unated States Patens 5312984. Amidation of vinyl chloride with dimethylamine using a supported palladium catalyst (англ.) (pdf). FreePatentsOnline (Sep 23, 1992). Дата обращения 29 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Kun Si. Kinetics and Mechanism of Vinyl Chloride Polymerization: Effects of Additives on Polymerization Rate, Molecular Weight, and Defect Concentration in the Polymer . — Cleveland: Case Western Reserve University, 2007. — 381 p.
- ↑ Jones FN Butadiene from vinyl chloride. Platinum(II)-catalyzed coupling of vinyl halides (англ.) // The Journal of Organic Chemistry. — 1967. — Vol. 32 , no. 5 — P. 1667–1668 .
- ↑ Unated States Patens 2137664. Alpha, beta-dihalogenethylketones (англ.) (pdf). FreePatentsOnline (Nov 22, 1938). Дата обращения 1 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Misono A., Uchida Y., Furuhata K. Formation of Acetals from Vinyl Chloride and Alcohols Catalyzed by Transition Metal Chlorides (англ.) // Bulletin of the Chemical Society of Japan. — 1970. — Vol. 43 , no. 4 — P. 1243—1244 . (inaccessible link)
- ↑ Gerhard M., Griesbaum K. Ozonolysis of vinyl chloride in methanol: a convenient entry to methoxymethylhydroperoxide and its chemistry (англ.) // Canadian journal of chemistry. — 1983. — Vol. 61 , no. 10 . — P. 2385—2388 . (inaccessible link)
- ↑ Hudlický M. Reductions in Organic Chemistry. — Chichester: Ellis Horwood Limited, 1984. — P. 66—67. — ISBN 0-85312-345-4 .
- ↑ Шелит Х. Хлористый винил // Пер. с англ./под ред. проф. В.В.Коршака Мономеры. Сборник статей. — М. : Издательство иностранной литературы, 1951. — Т. 1 . — С. 190-208 .
- ↑ Mарч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4 томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М. : «Мир», 1988. — Т. 3. — С. 353-354.
- ↑ 1 2 3 Производство винилхлорида . Новый справочник химика и технолога. Сырьё и продукты промышленности органических и неорганических веществ (часть II) (1 апреля 2009 года). Дата обращения 3 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 5 Production of Vinyl Chloride Monomer (VCM) // Assessment of Mercury Releases from the Russian Federation / Arctic Council Action Plan to Eliminate Pollution of the Arctic (ACAP), Russian Federal Service for Environmental, Technological and Atomic Supervision & Danish Environmental Protection Agency. — Copenhagen: Danish EPA, 2005. — P. 62—64.
- ↑ 1 2 Turov YY, Parshina GA Manufacture of analogous products on acetylene and olefins base in the US (англ.) // Chemistry and Technology of Fuels and Oils. — 1968. — Vol. 4 , no. 7 — P. 548—551 .
- ↑ 1 2 3 4 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide) . — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 311—323 p. — ISBN 978-92-832-1297-3 .
- ↑ Benyahia F. The VCM Process Economics: Global and Raw Material Impacts (англ.) (pdf). Proceedings of the 1st Annual Gas Processing Symposium . Norvegian University of Science and Technology. Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Linak E. Vinyl Chloride Monomer (VCM) (англ.) . CEH Report . SRI Consulting (June 2009). Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ 1 2 3 Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. and add. — М. : Химия, 1988. — С. 140—141. — ISBN 5-7245-0008-6 .
- ↑ 1 2 Vinyl chloride and polyvinyl chloride (англ.) (pdf). Publications . Uhde GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC DIRECT CHLORINATION Process using Boiling Reactor Technology and DIRECT CHLORINATION Catalyst (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC OXYCHLORINATION Process (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC DISTILLATION (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ EDC CRACKING Process (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ VCM DISTILLATION (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ BY-PRODUCT RECOVERY Process (англ.) . VinTec Licensing Activities . Vinnolit GmbH. Дата обращения 9 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 4 Chauvel A., Lefebvre G. Petrochemical processes 2. Major Oxygenated, Chlorinated and Nitrated Derivatives. — 2nd Edition. — Paris: Editions Technip, 1989. — Т. 2. — P. 184—187. — ISBN 2-7108-0563-4 .
- ↑ 1 2 New VCM Plant Will Use Ethane (англ.) . Hydrocarbon Online (September 9, 1999). Дата обращения 11 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Wilhelmshaven VCM Facility, Germany (англ.) . Industry Projects . Сhemicals-technology.com. Дата обращения 11 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ History (англ.) . INEOS. Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Spitz PH The chemical industry at the millenium: maturity, restructuring, and globalization. — Philadelphia: Chemical Heritage Foundation, 2003. — P. 77. — ISBN 0-941901-34-3 .
- ↑ Unated States Patens 4300005. Preparation of vinyl chloride (англ.) (pdf). FreePatentsOnline (Dec. 02, 1977). Дата обращения 3 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Unated States Patens 20060167325. Method for producing vinyl chloride monomer (англ.) (pdf). FreePatentsOnline (Jan. 24, 2005). Дата обращения 3 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Vinyl Chloride Monomer (VCM) (англ.) . Chemical Economics Handbook . IHS Markit (January 2015). Дата обращения 18 января 2017.
- ↑ Ethylene (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Propylene (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Methanol (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Terephthalic Acid (TPA) (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Benzene (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Ethylene (англ.) . WP Report . SRI Consulting (January 2009). Дата обращения 5 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Vinyl Chloride Monomer (VCM) (англ.) . WP Report . IHS (January 2011). Дата обращения 17 января 2012. Архивировано 23 января 2012 года.
- ↑ Vinyl Chloride Monomer (англ.) . WP Report . SRI Consulting (January 2009). Дата обращения 28 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Vinyl Chloride (англ.) . The Innovation Group. Дата обращения 5 ноября 2009.
- ↑ Product Safety Assessment: Vinyl Chloride Monomer (англ.) . Product Safety . Dow Chemical. Дата обращения 6 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Tickner JA Trends in World PVC Industry Expansion A Greenpeace White Paper (англ.) . Ecology Center (June 19, 1998). Архивировано 21 августа 2011 года.
- ↑ Chemical Industries Newsletter (англ.) (pdf). SRI Consulting (July 2006). Дата обращения 12 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Справка о состоянии «хлорной» отрасли химической промышленности России. Подготовлено Российским Центром «Хлорбезопасность» . Федеральная Антимонопольная Служба РФ (23 августа 2004). Дата обращения 27 октября 2009. Архивировано 21 августа 2011 года.
- ↑ История компании . ОАО «Саянскхимпласт». Дата обращения 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Годовой отчёт Открытого акционерного общества «Саянскхимпласт» 2008 год (pdf). ОАО «Саянскхимпласт». Дата обращения 1 декабря 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 3 Годовой отчёт Открытого Акционерного Общества «Каустик» за 2008 год (pdf). ОАО «Каустик». Дата обращения 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Официальный сайт Открытого акционерного общества «Пласткард» . ОАО «Пласткард». Дата обращения 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Годовой отчёт ОАО «Сибур-Нефтехим» за 2008 год . — ОАО «Сибур-Нефтехим», 2009. — 58 с.
- ↑ Годовой отчёт за 2008 год Волгоградского открытого акционерного общества «Химпром» (doc). ВОАО «Химпром». Дата обращения 1 декабря 2009.
- ↑ В присутствии Президента РФ состоялось торжественное открытие производственного комплекса «РусВинил» . rusvinyl.ru. Дата обращения 5 апреля 2018.
- ↑ Нижегородское правительство, Администрация Кстовского района и «Русвинил» 24 июня заключат соглашение о сотрудничестве . Р52.РУ (24.06.2009). Дата обращения 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ ООО «Карпатнефтехим» (ЗАО «ЛУКОР») . ОАО «Лукойл». Дата обращения 8 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Vinyl Chloride Monomer (VCM) Uses and Market Data (англ.) . ICIS.com. Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ 1 2 Анализ рентабельности и стоимости производства ПВХ в Европе и Юго-Восточной Азии (англ.) (pdf). Консалтинг, Нефтегазовая практика, 2010 год . Делойт и Туш Риджинал Консалтинг Сервисис Лимитед (2011). Дата обращения 3 февраля 2013. Архивировано 9 марта 2013 года.
- ↑ Pritchard G. PVC — World Markets and Prospects / Rapra Market Report. — Rapra Technology Limited, 2002. — P. 5. — ISBN 1-85957-311-8 .
- ↑ Attenberger P. Polyvinyl Chloride (PVC) (англ.) // Kunststoffe International. — 2011. — No. 10 . — P. 7-10 .
- ↑ Bloch HP, Godse A. Compressors and modern process applications. — John Wiley and Sons, 2006. — P. 322. — ISBN 978-0-471-72792-7 .
- ↑ Chisso PVC Process (англ.) (недоступная ссылка) . Chisso Corporation. Дата обращения 3 ноября 2009. Архивировано 22 апреля 2008 года.
- ↑ 1 2 SUSPENSION-PVC Process (англ.) . VinTec Licensing Activities . Vinnolit GmbH & Co. KG. Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ Weissermel K., Arpe H.-J. Industrial organic chemistry. — Fourth, Comletely Revised Edition. — Weinheim: Wiley-VCH, 2003. — P. 223—226. — ISBN 3-527-30578-5 .
- ↑ Public Health Statement for Vinyl Chloride (англ.) . Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения 4 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Винилхлорид (англ.) . ICSC / Международные карты Химической Безопасности . Институт промышленной безопасности, охраны труда и социального партнерства. Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ 1 2 Vinyl chloride (англ.) . Hardy Research Group, Department of Chemistry, The University of Akron. Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ IUCLID Dataset. Vinyl Chloride (pdf) (недоступная ссылка — история ) . European Commission's Joint Research Centre (19 Feb 2000). Дата обращения 27 октября 2009. (недоступная ссылка)
- ↑ 1 2 Vinyl chloride (англ.) . International Programme on Chemical Safety (IPCS). Дата обращения 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Spencer AB, Colonna GR Nfpa Guide to Hazardous Materials. — Quincy: National Fire Protection Association, 2003. — P. 165. — ISBN 0-87765-558-8 .
- ↑ Хлорпроизводные непредельных алифатических углеводородов . Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы . ChemAnalitica.com. Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs, Volumes 1 to 42, Supplement 7 . — Lyon: lnternational Agency for Research on Cancer, 1987. — P. 373—376. — ISBN 92-832-1411-0 . Архивировано 6 марта 2008 года. Архивная копия от 6 марта 2008 на Wayback Machine
- ↑ Vinyl Chloride CAS No. 75-01-4 (англ.) (pdf). National Institutes of Health within the US Department of Health and Human Services. Дата обращения 12 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Винилхлорид . Отравления профессиональные . Медицинский портал MedSite. Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Fazlul H. Molecular Modelling Analysis of the Metabolism of Vinyl Chloride (англ.) // Journal of Pharmacology and Toxicology. — 2006. — Vol. 1 , no. 4 — P. 299—316 . (inaccessible link)
- ↑ 1 2 3 4 Vinyl Chloride (англ.) (pdf). OECD Initial Assessment Reports For High Production Volume Chemicals including Screening Information Datasets (SIDS) . UNEP Chemicals (December 2006). Date of treatment November 5, 2009. Archived August 21, 2011.
- ↑ 1 2 3 ToxGuide TM for Vinyl Chloride (англ.) (pdf). Agency for Toxic Substances and Disease Registry (ATSDR). Дата обращения 2 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ Davis JW, Carpenter CL Aerobic Biodegradation of Vinyl Chloride in Groundwater Samples (англ.) // Applied and Enviromental Microbiology . — 1990. — Vol. 56 , no. 12 . — P. 3878—3880 .
- ↑ Barrio-Lage GA, Parsons FZ, Narbaitz RM, Lorenzo PA, Archer HE Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water (англ.) // Environmental Toxicology and Chemistry. — 1990. — Vol. 9 , no. 4 — P. 403—415 .
- ↑ Гигиенические нормативы (ПДК, ОБУВ, ОДУ) химических веществ в воздухе рабочей зоны, атмосферном воздухе населенных мест, воде водоемов . Новый справочник химика и технолога. Вредные химические вещества. Радиоактивные вещества. Гигиенические нормативы . ChemAnalitica.com. Дата обращения 21 сентября 2009. Архивировано 21 августа 2011 года.
- ↑ Maximum Exposure Limits (англ.) . The Physical and Theoretical Chemistry Laboratory Oxford University. Дата обращения 26 октября 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Safety Data Sheet. Vinyl Chloride (англ.) (pdf) (недоступная ссылка) . Gas Encyclopaedia . Air Liquide. Дата обращения 28 октября 2009. Архивировано 7 апреля 2009 года.
- ↑ Minimal Risk Levels (MRLs) (англ.) (pdf). Agency for Toxic Substances and Disease Registry (ATSDR) (December 2008). Дата обращения 4 ноября 2009. Архивировано 21 августа 2011 года.
- ↑ VCM (Vinyl Chloride Monomer) (англ.) . Chemicals . Saudi Basic Industries Corporation (SABIC). Дата обращения 7 декабря 2009. Архивировано 21 августа 2011 года.
Литература и прочие внешние источники
Monographs
- Флид М. Р., Трегер Ю. А. Винилхлорид: химия и технология. В 2 книгах. — М. : Калвис, 2008. — 584 с. — ISBN 978-5-89530-019-0 .
Химия, промышленное производство и применение винилхлорида
- Елфимова С. Н., Яковенко Д. Ю. Вариант модернизации технологии получения винилхлорида из 1,2-дихлорэтана (рус.) // Альманах современной науки и образования, Тамбов: Грамота. — 2011. — № 5 (48) . — С. 69-70 .
- Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. — 4-е изд., перераб. and add. — М. : «Химия», 1988. — С. 126-127; 140-141; 146-152. — ISBN 5-7245-0008-6 .
- Технология производства винилхлорида и поливинилхлорида (pdf) (недоступная ссылка) 34. Uhde GmbH (30 мая 2012). Дата обращения 15 июля 2014. Архивировано 16 июля 2014 года.
- Флид М. Р. Состояние и перспективы развития производства винилхлорида − мономера для получения ПВХ (pdf). Дата обращения 15 июля 2014.
- Юкельсон И. И. Технология основного органического синтеза. — М. : «Химия», 1968. — С. 299-310.
- Barnes AW Vinyl Chloride and the Production of PVC (англ.) // Proceeding of the Royal Society of Medicine. — 1976. — Vol. 69 , no. 4 — P. 277-281 .
- Cowfer JA Part 2. Vinyl Chloride Monomer // PVC Handbook / Wilkes CE, Summers JW, Daniels CA. — 1 st ed. — Minich: Carl Hanser Verlag, 2005. — P. 19-56. — ISBN 1-56990-379-4 .
- Kun Si. Vinyl Chloride Polymerization in presence of Organic Additives: New Kinetics and Mechanism of Vinyl Chloride Polymerization and Correlation between Structural defects and Dehydrochlorination of Polyvinyl Chloride. — VDM Verlag, 2010. — 288 p. — ISBN 978-3-6392-1368-3 .
- Naqvi MK, Kulshreshtha AK Vinyl Chloride Manufacture: Technology Trends and an Energy Economic Perspective (англ.) // Polymer-Plastics Technology and Engineering. — 1995. — Vol. 34 , no. 2 . — P. 213-226 .
- Saeki Y., Emura T. Technical progresses for PVC production (англ.) // Progress in Polymer Science. - 2002. - Vol. 27 , no. 10 . — P. 2055-2131 .
- Sittig M. Vinyl Chloride and PVC Manufacture: Process and Environmental Aspects (Pollution Technology Review). — Noyes Data Corporation, 1978. — 350 p. — ISBN 978-0815507079 .
- Vinyl Chloride // Kirk-Othmer Encyclopedia of Chemical Technology. Elastomers, synthetic to Expert Systems. — 4-th edition. — New York: John Wiley & Sons, 1994. — Т. 24. — P. 413-425.
Физиологическое воздействие винилхлорида
- Могиленкова Л. А. Воздействие винилхлорида на состояние здоровья работающих в производственных условиях (обзор) (рус.) // Профилактическая медицина. — 2011. — Т. 11, июнь . — С. 558-571 .
- Barrio-Lage GA, Parsons FZ, Narbaitz RM, Lorenzo PA, Archer HE Enhanced Anaerobic Biodegradation Iof Vintyl Chloride in Ground Water (англ.) // Environmental Toxicology and Chemistry. - 1990. - Vol. 9 , no. 4 — P. 403-415 .
- 1,3-Butadiene, Ethylene Oxide and Vinyl Halides (Vinyl Fluoride, Vinyl Chloride and Vinyl Bromide) . — IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 97. — Lyon: International Agency for Research on Cancer, 2008. — 525 p. — ISBN 978-92-832-1297-3 .
- Environmental Health Criteria 215. Vinyl Chloride . — Geneva: World Health Organization, 1999. — 382 p. — ISBN 92-4-157215-9 .
- Fazlul H. Molecular Modelling Analysis of the Metabolism of Vinyl Chloride (англ.) // Journal of Pharmacology and Toxicology. - 2006. - Vol. 1 , no. 4 — P. 299-316 . (inaccessible link)
- Hartmans S., De Bont JA Aerobic Vinyl Chloride Metabolism in Mycobacterium aurum LI (англ.) // Applied and Enviromental Microbiology . — 1992. — Vol. 58 , no. 4 — P. 3878-3880 .
- IUCLID Dataset. Vinyl Chloride (англ.) (pdf) (недоступная ссылка — история ) . European Commission's Joint Research Centre (19 Feb 2000). Дата обращения 27 октября 2009. (недоступная ссылка)
- Plugge H., Safe S. Vinyl chloride metabolism — A review (англ.) // Chemosphere. — 1977. — Vol. 6 , no. 6 — P. 309-325 .
- Selikoff IJ, Hammond EC Toxicity of Vinyl Chloride — Polyvinyl Chloride. — Annals of New York Academy of Sciences. — New York: New York Academy of Sciences, 1975. — P. 337.
- Toxicological profile for vinyl chloride . — Agency for Toxic Substances and Disease Registry US Public Health Service, 2006. — 328 p.
- Vinyl Chloride (BUA Report) / Gesellschaft Deutscher Chemiker Advisory Committee. — Wiley-VCH Verlag GmbH, 1992. — 99 p. — ISBN 978-3527285242 .
- Vinyl Chloride in Drinking-water / Background document for development of WHO Guidelines for Drinking-water Quality. — World Health Organization, 2004. — 23 p.
- Vinyl chloride: health and safety guide / International Program on Chemical Safety, United Nations Environment Programme, International Labour Organisation, World Health Organization, Inter-Organization Programme for the Sound Management of Chemicals. — Geneva: World Health Organization, 1999. — 28 p. — ISBN 92-4-151109-5 .